



Ciencia de las Plantas
Micropropagación de teca (Tectona grandis Linn F.) con el empleo de biorreactores económicos de inmersión temporal
Micropropagation of teak (Tectona grandis Linn F.) using economical temporary immersion bioreactors
La Calera
Universidad Nacional Agraria, Nicaragua
ISSN: 1998-7846
ISSN-e: 1998-8850
Periodicidad: Semestral
vol. 24, núm. 42, 2024
Recepción: 06 Septiembre 2023
Aprobación: 19 Abril 2024
Resumen: La micropropagación de teca (Tectona grandis Linn F.) permite multiplicar plantas elites de forma asexual en ambientes controlados. Con el empleo de biorreactores económicos de inmersión temporal, innovación generada en el laboratorio de cultivo de tejidos de la Universidad Nacional Agraria, en Managua, Nicaragua, se realizó esta investigación con el objetivo de evaluar el efecto de reguladores del crecimiento en yemas apicales y axilares en las fases de multiplicación y enraizamiento. Este trabajo se desarrolló en tres fases posteriores a la obtención del material vegetal in vitro que corresponden a: 1) respuesta morfogénica de segmentos de tallos, 2) respuesta morfogénica a la densidad de siembra y 3) respuesta rizogénica de segmentos de tallos. Se demostró que, en la micropropagación de teca con yemas apicales individuales y segmentos de tallos con un entrenudo y sin yema apical, resultó mejor el promedio de número de hojas con la adición de 1.00 mg L-1 de 6-BAP y 0.10 mg L-1 de GA., mientras que con yemas apicales con dos o tres entrenudos el promedio de número de hojas resultó superior en el medio de cultivo que contenía 0.50 mg L-1 de 6-BAP combinado con 0.05 o 0.10 mg L-1 de GA.. La densidad de siembra de 30 yemas apicales con dos entrenudos y densidad de 40 yemas apicales o axilares logra mayor número de hojas. Con yemas apicales y axilares con dos entrenudos, las variables longitud del tallo, número de hojas y número de raíces, presentan similar comportamiento con las adiciones de 0.25 mg L-1, 0.50 mg L-1 y 0.75 mg L-1 de ácido indol acético, además, la categoría de buen vigor se obtiene en mayor porcentaje (60 % - 70 %) con el uso de estas variantes de medio de cultivo.
Palabras clave: yemas apicales, yemas axilares, respuesta morfogénica, respuesta rizogénica, medio de cultivo.
Abstract: Micropropagation of teak (Tectona grandis Linn F.) allows the asexual multiplication of elite plants in controlled environments. With the use of economical bioreactors of temporary immersion, an innovation generated in the tissue culture laboratory of the Universidad Nacional Agraria, in Managua, Nicaragua, this research was carried out with the objective of evaluating the effect of growth regulators in apical and axillary buds in the multiplication and rooting phases. This work was developed in three phases after obtaining the in vitro plant material, corresponding to: 1) morphogenic response of stem segments, 2) morphogenic response to plant density and 3) rhizogenic response of stem segments. It was shown that, in teak micropropagation with single apical buds and stem segments with one internode and without apical bud, the average number of leaves was better with the addition of 1.00 mg L-1 of 6-BAP and 0.10 mg L-1 of GA., while with apical buds with two or three internodes the average number of leaves was higher in the culture medium containing 0.50 mg L-1 of 6-BAP combined with 0.05 or 0.10 mg L-1 of GA. The planting density of 30 apical buds with two internodes and density of 40 apical or axillary buds achieved higher leaf number. With apical and axillary buds with two internodes, the variables stem length, number of leaves and number of roots, show similar behavior with the additions of 0.25 mg L-1, 0.50 mg L-1 and 0.75 mg L-1 of indole acetic acid, in addition, the category of good vigor is obtained in a higher percentage (60 % - 70 %) with the use of these variants of culture medium.
Keywords: apical buds, axillary buds, morphogenic response, rhizogenic response, culture medium.
En Nicaragua, en el año 2015 las plantaciones forestales se estimaron en 39 078 km2, lo que representa el 30 % del territorio nacional que beneficia a 80 mil trabajadores, que equivale al 0.8 por ciento de la fuerza laboral formal (De Camino, 2018).
Upadhyay et al. (2005) y Bhat e Índira, (1997) citados por Rodríguez et al., (2014) destacan que la madera de teca es de alto valor comercial, debido a sus propiedades físico-mecánicas que la hacen una de las más apropiadas y durables para la construcción, fabricación de muebles, puertas y ventanas; y es considerada la de mejor estabilidad dimensional, por su bajo punto de saturación de fibra y contracción.
La producción de plántulas a partir de semillas produce mucha variabilidad en el crecimiento, mientras que con el uso de la reproducción vegetativa se obtiene material uniforme y de calidad, se transportan a distancias considerables sin producir mortalidad, se planta con mayor facilidad y rapidez. Además, el crecimiento posterior a la siembra es más rápido y vigoroso (Fonseca, 2004, p. 30). Engelmann y Takagi, (2000) citados por Abdelnour y Muñoz (2005) destacan que la inclusión de técnicas de micropropagación en los programas de mejoramiento genético y establecimiento de plantaciones permite la clonación masiva de los árboles superiores en tiempo y espacio reducido, conservando las características valiosas de los materiales. Otra ventaja de la micropropagación es que facilita la comercialización y transporte de las plantas a lugares y países lejanos con menores restricciones aduaneras y menores posibilidades de pérdida de materiales.
Polo Santos et al. (2013), plantean que una alternativa para la reproducción vegetativa de teca es la propagación de plantas a través de la micropropagación, que se fundamenta en la clonación de material vegetal élite, presentando altas tasas de multiplicación y buenas características genotípicas y fenotípicas como altura, rectitud de fuste, copa y alto rendimiento de madera (p. 85). Además “permite propagar árboles seleccionados por sus características fenotípicas y alto rendimiento de la madera, incrementando la tasa de multiplicación y manteniendo un alto nivel de sanidad y estabilidad genética” (p. 83).
Castillo et al., (2019) recomiendan que, para emplear la micropropagación de teca como actividad comercial, es necesario disponer de tecnologías como los biorreactores de inmersión temporal, que utiliza medios líquidos. Los medios líquidos presentan la ventaja que los explantes tienen mayor facilidad de absorción de los nutrientes, debido a la formación de una película acuosa que cubre el tejido vegetal.
Los Biorreactores Económicos de Inmersión Temporal (BEIT) desarrollados en la Universidad Nacional Agraria (UNA) en Managua, capital de Nicaragua, funcionan en un solo recipiente de vidrio, donde se inyecta aire comprimido suministrado por una bomba de vacío, permitiendo que el medio de cultivo líquido suba hasta la parte superior del material poliuretano donde se colocan los tejidos, permitiendo que se remuevan los tejidos y se oxigenen durante el tiempo de inmersión y una vez que se suspenda la presión de aire, el medio líquido se asienta. Además, para evitar la contaminación de microrganismos dentro de los biorreactores, sobre la tapa de este se colocan dos filtros de acetato de celulosa (Cruz, 2020, p. 15).
Con la utilización de los biorreactores en la micropropagación de teca y el empleo de diferentes tipos de tejidos es posible mejorar el proceso de producción masiva en la micropropagación de teca. El objetivo de este estudio es evaluar la respuesta morfogénica y rizogénica de segmentos de tallos de teca con el uso de biorreactores económicos de inmersión temporal
MATERIALES Y MÉTODOS
Ubicación del área de estudio
El estudio se realizó de febrero del 2021 a agosto del 2022 en el laboratorio de cultivo de tejido de la Universidad Nacional Agraria (UNA), ubicado en el km 12 ½ Carretera Norte en el departamento de Managua, capital de Nicaragua; se localiza en las coordenadas geográficas de 12°08´58.3´´ de latitud Norte y 86°09´37.0´´ de longitud Oeste.
Selección del material y establecimiento
Se extrajeron brotes de los árboles de teca establecidos en el vivero del laboratorio de cultivo de tejido de la UNA. Una vez extraídos los brotes, se sumergieron en una solución preparada con detergente comercial durante 20 minutos y posteriormente se realizaron tres lavados sucesivos con detergente; con ayuda de cepillos se extrajeron los residuos de polvo y suciedad. En la cámara de flujo laminar, los tejidos se redujeron a un tamaño aproximado de 0.5 cm con ayuda de escalpelos previamente esterilizados para establecerlos en tubos de ensayo en un medio de cultivo con sales de Murashige y Skoog (MS, 1962) con 30 g L-1 de sacarosa. Después de ocho semanas que se formaron las plantas, se procedió a efectuar la primera multiplicación para incrementar la cantidad de yemas apicales y axilares.
Una vez obtenido el material vegetal, el estudio se desarrolló en tres fases, cada una con su propia metodología y análisis estadístico.
Fase 1. Repuesta morfogénica de segmentos de tallos
Se estudió la respuesta de nueve tipos de segmentos de tallos: yema apical individual, segundo entrenudo individual y tercer entrenudo individual (Figura 1); segmento de tallo con yema apical, yema apical con dos entrenudos y yema apical con tres entrenudos (Figura 2); segmentos de tallo con un entrenudo sin yema apical, segmentos de tallo con dos entrenudos sin yema apical y segmentos de tallo con tres entrenudos sin yema apical (Figura 3).



Cada tipo de segmento fue establecido en BEIT de vidrio con capacidad de un litro, a los que se le agregó 200 ml de medio de cultivo constituido por las sales básicas de Muraschige y Skoog (MS, 1962), con 30 g L-1 de sacarosa y con las variantes de concentraciones de reguladores del crecimiento correspondientes a cada tratamiento (Cuadro 1). El pH se ajustó a 5.8, con ácido clorhídrico (HCl) a 0.5 N e hidróxido de potasio (KOH) a 0.5 N. Por cada tipo de segmento de teca, se sembraron 20 tejidos en BEIT (nueve recipientes por tratamiento) con cada uno de los cuatro tratamientos obtenidos de la combinación de las hormonas 6-BAP y GA3.
| Tratamiento | Reguladores de crecimiento | ||
| 6-BAP* (mg L-1) | GA3** (mg L-1) | ||
| 6-BAP+GA3 | 0.50 | + | 0.05 |
| 6-BAP+GA3 | 0.50 | + | 0.10 |
| 6-BAP+GA3 | 1.00 | + | 0.05 |
| 6-BAP+GA3 | 1.00 | + | 0.10 |
*6-Bencil amino purina, **Ácido giberélico.
Posteriormente los BEIT se trasladaron al cuarto de crecimiento donde se realizó un riego de inmersión de dos minutos por día, la intensidad de luz establecida fue de 2 000 lux por 12 horas luz natural durante el período que se determinó para evaluar los resultados de la fase 1.
Variable evaluada
En esta primera fase, a las cuatro semanas después de realizada la siembra de los segmentos de tallo, se evaluó el número de hojas en plantas formadas en los BEIT según el tipo de segmentos. El proceso consistió en contabilizar el número de hojas nuevas producidas por los segmentos de tallo. En plantas como teca, la producción de hojas por planta es muy importante, porque en la base del pecíolo se encuentra una yema axilar que brotará cuando se corte cada segmento de tallo, y en el caso de los segmentos de tallo que tienen su yema apical, por acción de los constituyentes del medio de cultivo líquido o semisólido, continuarán con su crecimiento.
Diseño estadístico
Para evaluar el número de hojas, se estableció un Diseño Completo al Azar (DCA) con arreglo unifactorial. Como unidad experimental se consideró un BEIT que contenía 20 segmentos de tallos cada uno originando una planta debidamente formada a los 28 días y se evaluaron aleatoriamente 15 por cada tratamiento. Se realizó análisis de varianza (ANDEVA) y para determinar las diferencias estadísticas entre los tratamientos, se empleó la prueba de rangos múltiples de Duncan con α = 0.05. Los procedimientos estadísticos se realizaron con el programa estadístico INFOSTAT versión 2020.
Fase 2. Respuesta morfogénica a la densidad de siembra
Se estudió la respuesta en el crecimiento de segmentos de tallo con yema apical y con yemas axilares conteniendo dos pares de hojas por efecto de la densidad de siembra de 30, 40, 50 y 60 segmentos por BEIT de tres litros de capacidad, conteniendo cada uno 700 ml de medio de cultivo líquido. Se empleó el medio de cultivo que contenía concentraciones de 1.00 mg L-1 de 6-BAP y 0.10 mg L-1 GA3 considerando que resultó favorable en la emisión de hojas en la fase 1.
Variables evaluadas
A las cuatro semanas de establecida la fase 2, se evaluaron las variables número de hojas y la longitud del tallo producida por los dos tipos de segmentos de tallo; la longitud del tallo se midió con una regla milimétrica graduada en centímetro bajo condiciones de asepsia en la cámara de flujo laminar; considerando la longitud de la base de la planta hasta la yema apical. En el caso de los segmentos de tallos que para efectos del estudio se les eliminó la yema apical, se midió la longitud del brote principal.
Diseño estadístico
Se utilizó un DCA con un arreglo bifactorial 4 x 2 (cuatro densidades de siembra y dos tipos de yemas) para un total de ocho tratamientos, requiriéndose en las cuatro densidades de siembra 180 segmentos de tallo por cada tipo de yema. Como unidad experimental se consideró un BEIT y se evaluaron por cada tratamiento 15 tejidos tomados al azar. A los datos obtenidos se les realizó un análisis de varianza (ANDEVA) y para determinar las mejores medias de los tratamientos, se empleó la prueba de rangos múltiples de Duncan α = 0.05. Los datos se procesaron y analizaron en el paquete estadístico INFOSTAT versión 2020.
Fase 3. Respuesta rizogénica de segmentos de tallos
Los tratamientos consistieron en la adición de 0, 0.25, 0.50, 0.75 y 1.00 mg L-1 de Ácido Indol Acético (AIA). Se agregó una cantidad de 700 ml de medio de cultivo en cada BEIT con capacidad de tres litros. Se definieron cinco variantes de medios de cultivo y a cuatro de ellas se les agregó AIA (Cuadro 2). En esta fase se utilizaron 350 segmentos de tallo apicales y 350 de tallo axilares que fueron extraídos de plantas formadas en los BEIT en la fase 2.
| Variantes de medios de cultivo | Concentración de AIA* (mg L-1) |
| MS | 0.00 |
| MS + AIA | 0.25 |
| MS + AIA | 0.50 |
| MS + AIA | 0.75 |
| MS + AIA | 1.00 |
*Ácido Indol Acético.
Variables evaluadas
A las cuatro semanas, se tomaron 15 plantas al azar por tratamiento y a cada una se le evaluaron cuatro variables: a) número de hojas producidas por segmentos de tallos; b) longitud del tallo, considerando la longitud de la base de la planta hasta la yema apical y en el caso de los segmentos de tallos que se les eliminó la yema apical, se midió la longitud del brote principal axilar; c) el número de raíces producidas por segmentos de tallo y d) vigor de las plantas, en esta variable se definió una escala de vigor de acuerdo a las expresiones morfológicas de las hojas formadas: Bajo vigor: hojas del segundo entrenudo con ancho < 0.50 cm y largo < de 1 cm y longitud de tallo < de 8 cm. Vigor mediano: hojas del segundo entrenudo con ancho entre 0.5 y 1 cm y largo entre 1 cm y 2 cm, con longitud de tallo entre 8 cm y 10 cm. Las hojas con Buen vigor corresponden a aquellas en el segundo entrenudo con ancho > a 1cm y largo > a 2 cm, con longitud de tallo > de 10 cm (Figura 4).

Diseño estadístico
Se utilizó un DCA con un arreglo bifactorial 5 x 2 (5 variantes de medios de cultivo y 2 tipos de yemas) para un total de 10 tratamientos con una sola réplica a la que se le realizó un análisis de varianza (ANDEVA) y prueba de rangos múltiples de Duncan α = 0.05. Los datos se procesaron y analizaron en el paquete estadístico INFOSTAT versión 2020. Por cada tratamiento se sembraron 70 segmentos de tallo con dos hojas, que es el tipo de tejido que reportan Polo Santos et al. (2013) como el que regularmente se emplea en la rutina de multiplicación de teca. El análisis estadístico se realizó por tipo de yema (con yema apical o sin yema apical) en BEIT de tres litros, empleándose 350 segmentos de tallo con yema apical en los cinco tratamientos e igual número para la siembra de los segmentos de tallo sin yema apical. En total se sembraron 700 segmentos de tallo en diez BEIT y después de cuatro semanas se evaluaron al azar 30 plantas por cada tratamiento. Cada BEIT constituyó una unidad experimental.
RESULTADOS Y DISCUSIÓN
Fase 1. Repuesta morfogénica de segmentos de tallos
Número de hojas según yemas apicales individuales. En yema apical con adiciones de 0.50 mg L-1 de 6-BAP y 0.10 mg L-1 de GA3 se presentó la menor cantidad de hojas, superado estadísticamente solo por el tratamiento que contenía 1.00 mg L-1 de 6-BAP y 0.10 mg L-1 de GA3. Con yemas axilares individuales del segundo entrenudo, los brotes principales presentaron mayor número de hojas en el tratamiento con 0.50 mg L-1 de 6-BAP y 0.05 mg L-1 de GA3. Las yemas individuales que se extrajeron del tercer entrenudo no difieren estadísticamente (Cuadro 3).
| Tratamientos | Yema individual | ||||
| 6-BAP (mg L-1) | GA3 (mg L-1) | Yema apical | Segundo entrenudo | Tercer entrenudo | |
| 0.50 | + | 0.05 | 2.47 ab | 3.27 a | 2.67 a |
| 0.50 | + | 0.10 | 1.87 b | 2.80 ab | 2.33 a |
| 1.00 | + | 0.05 | 2.53 ab | 2.40 b | 2.00 a |
| 1.00 | + | 0.10 | 2.87 a | 2.60 b | 3.40 a |
Letras desiguales difieren para p <= 0.05.
Rojas y Abdelnour (2012) recomiendan la experimentación en la inducción de brotación ya que el comportamiento de las diferentes maderables y aún de los diferentes explantes de una misma especie pueden responder de manera particular, logrando en teca los mejores resultados con el uso de AIA como único regulador del crecimiento que fue más efectivo para estimular la brotación de las yemas dormantes en los nudos y para evitar la formación de callo que podría conducir a variantes no deseadas.
Con el empleo de los tres tipos de yemas individuales en la fase de multiplicación se demostró que en teca las adiciones combinadas de BAP y de GA3 estimularon la brotación que formaron plantas completas únicas. En esta fase no se adicionó AIA considerando los resultados de Abdelnour y Muñoz (2005), quienes reportan incrementos en el porcentaje de microestacas que produjeron callo en lugar de brotes (45 %.) cuando agregaron al medio de multiplicación una concentración de 0.20 mg L-1 de AIA, además disminuyó la brotación en 55 %, lo mismo que el número de ejes por estacas (dos ejes).
Rojas y Abdelnour (2012) en la micropropagación de teca, atribuyen a la adición de bencilaminopurina (BA) como responsable primario de la formación de callo, puesto que cuando el AIA fue combinado con concentraciones de 0.50, 1 y 2 mg L-1 de BA, se produjeron altos porcentajes de formación de callo. Mendoza et al., (2007) citados por Polo Santos et al. (2013), afirman que en la micropropagación de teca la adición exógena de citocininas promueve el rompimiento de la dominancia apical y estimula la activación del crecimiento de los meristemos axilares presentes en los explantes cultivados in vitro.
Número de hojas según segmento de tallo con yema apical. Los segmentos de tallos conformados por la yema apical y un entrenudo presentaron similar respuesta estadística en todas las combinaciones de 6-BAP y GA3. Los segmentos de tallo con yema apical y dos entrenudos obtuvieron la mejor media de número de hojas en el tratamiento que contenía 0.50 mg L-1 de 6-BAP combinado con 0.05 o 0.10 mg L-1 de GA3. La mayor cantidad de hojas en las yemas apicales con tres entrenudos se obtuvo con la adición de 0.50 o 1.00 mg L-1 de 6-BAP combinado con 0.05 mg L-1 de GA3, (Cuadro 4).
| Tratamientos | Yema apical | ||||
| 6-BAP (mg L-1) | GA3 (mg L-1) | Un entrenudo | Dos entrenudos | Tres entrenudos | |
| 0.50 | + | 0.05 | 3.07 ab | 4.00 a | 5.60 a |
| 0.50 | + | 0.10 | 3.60 a | 3.40 ab | 4.33 b |
| 1.00 | + | 0.05 | 3.53 a | 2.40 bc | 5.07 a |
| 1.00 | + | 0.10 | 3.27 a | 2.00 c | 3.67 b |
Estos resultados fueron superiores al número de hojas logradas con los tres tipos de yemas individuales, respuesta que puede atribuirse a que estas yemas tienen menos reservas nutritivas y hormonales en los segmentos nodales. Allccaco (2016) logró mejores resultados en frambuesa roja Rubus idaeus var. Heritage con el empleo de segmentos apicales en el medio de cultivo MS con 1.50 mg L-1 de 6-BAP, obteniendo un promedio de 1.80 ± 0.42 brotes por explante, mientras que con tejidos de miniestacas resultó mejor el promedio de brotación con 5.40 ± 0.98 brotes por explante en el medio de cultivo MS que contenía 1.00 mg L-1 de 6-BAP con 0.50 mg L-1 de GA3.
Número de hojas en segmentos de tallo sin yema axilar. En los segmentos de tallos con un entrenudo el promedio de número de hojas producidas en el medio de cultivo con 1.00 mg L-1 de 6-BAP y 0.10 mg L-1 de GA3 únicamente superó a la media obtenida en el medio de cultivo con 0.50 mg L-1 de 6-BAP y 0.05 mg L-1 de GA3. En esta misma variable empleando segmentos de tallo que tenían dos o tres entrenudos no presentaron diferencias estadísticas en las cuatro combinaciones de 6-BAP y de GA3 (Cuadro 5).
| Tratamientos | Yema axilar | ||||
| 6-BAP (mg L-1) | GA3 (mg L-1) | Un entrenudo | Dos entrenudos | Tres entrenudos | |
| 0.50 | + | 0.05 | 2.35 b | 3.20 a | 3.60 a |
| 0.50 | + | 0.10 | 2.70 ab | 3.50 a | 3.90 a |
| 1.00 | + | 0.05 | 3.00 ab | 3.50 a | 4.30 a |
| 1.00 | + | 0.10 | 3.35 a | 3.60 a | 4.20 a |
En la primera fase, se evaluó la producción de hojas en las plantas formadas en cada tipo de tejido, con el objetivo de conocer si los reguladores de crecimiento adicionados a los medios de cultivo tenían efecto en la eliminación de la dominancia en esos segmentos de tallo. Además del efecto del BAP y del GA3, otro factor que puede contribuir en la eliminación de la dormancia de las yemas son las condiciones internas que presenta el biorreactor modelo BEIT que favorece la activación fisiológica de las yemas, ya sea de forma individual o conteniendo dos o tres entrenudos con o sin yema apical. Con los resultados obtenidos consideramos que es posible mejorarlos, experimentando con otros reguladores de crecimiento adicionados solos o combinados y probando además diferentes concentraciones. También es necesario experimentar el efecto en la micropropagación de teca aumentado la frecuencia de inmersión de los tejidos en el modelo de biorreactor BEIT. Igarza et al., (2015) empleando Biorreactores de Inmersión Temporal (SIT) en la variedad de papa cv. Andinita’ observaron que las plantas obtenidas con una inmersión de medio de cultivo cada cuatro horas se desarrollaron entre tres y cinco nuevos tallos a partir de sus yemas axilares, a diferencia de las plantas que se obtuvieron con una inmersión cada dos horas, en las cuales no se estimuló la brotación de estas yemas.

Fase 2. Respuesta morfogénica a la densidad de siembra
De la fase anterior, se selecciona el medio de cultivo de 1.00 mg L-1 de 6- BAP con 0.10 mg L-1 de GA3 debido a los resultados favorables. En esta fase, las yemas axilares fueron evaluadas sobre la base de la brotación del tallo principal.
Longitud del tallo
No se presentaron diferencias estadísticas entre las densidades de siembra de 30, 40, 50 y 60 segmentos de tallo extraídos de yemas apicales y axilares.
Número de hojas
La densidad de siembra de 30 segmentos de tallo con yema apical superó en número de hojas a las obtenidas con el empleo de yemas axilares con igual densidad, así como a las yemas apicales y axilares con densidades de 50 y 60 segmentos de tallo (Cuadro 6).
| Tratamientos | Densidad | Tipo de yema | Longitud de tallo (cm) | Número de hojas |
| T1 | 30 | Yema axilar | 3.63 a | 3.53 c |
| T2 | 30 | Yema apical | 3.60 a | 5.80 a |
| T3 | 40 | Yema axilar | 3.37 a | 5.07 ab |
| T4 | 40 | Yema apical | 3.28 a | 5.53 ab |
| T5 | 50 | Yema axilar | 2.40 a | 3.73 c |
| T6 | 50 | Yema apical | 2.70 a | 4.53 bc |
| T7 | 60 | Yema axilar | 3.30 a | 4.40 bc |
| T8 | 60 | Yema apical | 3.00 a | 4.47 bc |
Letras desiguales difieren para p <= 0.05.
La densidad de siembra de los tejidos en teca de acuerdo con los resultados parece tener influencia en el crecimiento de las plantas. Por tanto, es necesario comprobar si la densidad es determinante en la respuesta morfológica por efecto que se produce por la competencia por luz, por la cantidad de medio de cultivo que le corresponde a cada tejido o por la frecuencia y duración de la inmersión.
Aguilar et al. (2019) experimentando con densidades de cultivo de 30 y 60 explantes nodales de teca por biorreactor modelo RITA®, en un medio suplementado con 0.50 mg.L−1 de BA y Kinetina, determinaron que el número promedio de brotes por explante aumentó ligeramente con una densidad de 30 explantes en comparación a 60 explantes por biorreactor, mostrando diferencias significativas en el primer experimento de cultivo de 45 días.
Fase 3. Respuesta rizogénica de segmentos de tallo
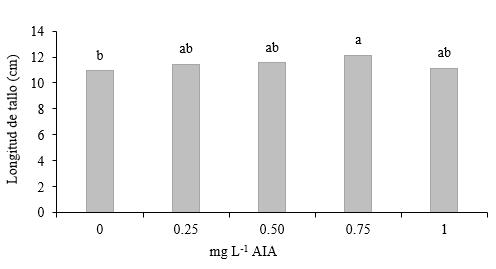
Longitud del tallo en segmentos de dos entrenudos con yema apical. El tratamiento con la adición 0.75 mg L-1 de AIA registra 12.15 cm de longitud y superó a la media de 10.94 cm lograda en el tratamiento sin AIA (Figura 6).
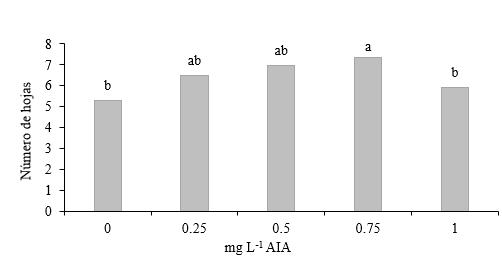
Número de hojas en segmentos de tallos con dos entrenudos con yema apical. En la variable número de hojas se presentaron diferencias estadísticas entre la media de 7.80 hojas producidas con el tratamiento de 0.75 mg L-1 de AIA y las obtenidas con los tratamientos de 1.00 mg L-1 de AIA y el testigo (Figura 7).
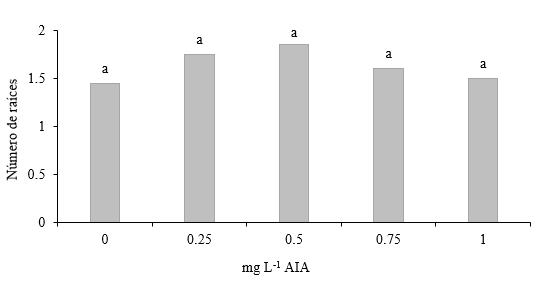
Número de raíces en segmentos de tallos con dos entrenudos con yema apical. No se presentaron diferencias estadísticas entre las medias de los diferentes tratamientos (Figura 8). Estos resultados indican que el enraizamiento de plantas in vitro de teca fue reducido, oscilando los valores de las medias de raíces entre 1.45 y 1.85. La baja respuesta al enraizamiento in vitro de teca lo reportan Castro et al. (2002) señalando que es una limitante particularmente si se requiere propagar masivamente esta especie forestal.
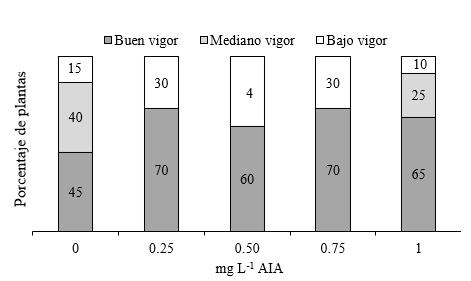
Vigor de plantas de segmentos de tallos con dos entrenudos con yema apical. Se obtuvieron entre 60 % y 70 % de plantas con buen vigor usando las variantes de medios de cultivos suplementados con AIA. No se registran plantas con mediano vigor cuando se adicionan a los medios 0.25 mg L-1, 0.50 mg L-1 y 0.75 mg L-1 de AIA. El menor porcentaje de plantas con buen vigor se presentó con el tratamiento sin AIA (Figura 9). La inducción de raíces por efecto de los tratamientos fue reducida, aunque en longitud de planta y plantas con buen vigor se obtuvieron los mejores resultados con todas las adiciones de AIA. Aldelnour y Muñoz (2005) inoculando brotes apicales de teca con dos o tres en las sales MS (1962) al 100 % o reducidas a la mitad y en ausencia de reguladores de crecimiento, observaron que únicamente el 8 % y el 18 % respectivamente desarrollaron raíces.
Plantas con buen vigor facilitan la inducción de raíces cuando se hace ex vitro en la aclimatación como lo recomiendan Daquinta et al. (2001) quienes además reportan buenos resultados de enraizamiento cuando trataron plantas in vitro de teca tratadas con 1 000 mg L-1 de ANA y 1 000 mg L-1 de AIB incrementando así el número y longitud de raíces.
Longitud del tallo en segmentos de tallo con dos entrenudos sin yema apical. En longitud de tallo, los tratamientos que contenían dosis de 0.50 y 0.75 mg L-1 de AIA obtuvieron medias de 12.35 cm y 12.37 cm, superando a las medias logradas en los tratamientos sin adición de AIA y con 1.00 mg L-1 de AIA, con medias respectivas de 6.10 cm y 11.40 cm (Figura 10).
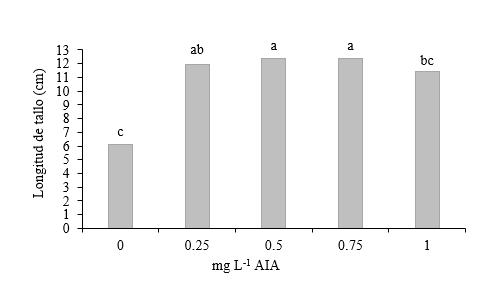
En todas las fases estudiadas a las cuatro semanas de evaluación no se observó que los segmentos de tallos estimularan la brotación múltiple, sino que los segmentos de tallo formaron plantas individuales producto de la activación de la yema apical o de solo una de las yemas de los segmentos nodales sin yema apical.
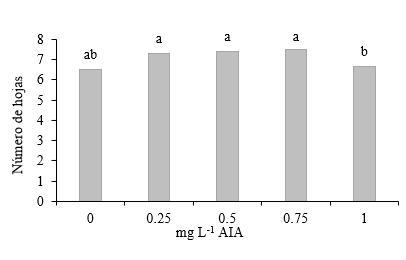
Número de hojas en segmentos de tallo con dos entrenudos sin yema apical. El número de hojas obtenida con la adición de 1.00 mg L-1 de AIA resultó significativamente inferior a las logradas con adiciones de 0.25, 0.50 y 0.75 mg L-1 de AIA (Figura 11).
Número de raíces en segmentos de tallo con dos entrenudos sin yema apical. Al igual que el número de raíces en segmentos de tallo con dos entrenudos con yema apical (Figura 8), sin yema apical no se presentan diferencias estadísticas (Figura 12).
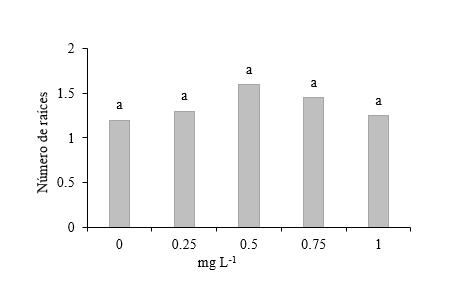
Polo Santos et al. (2013) señalan que independientemente de su tamaño, las raíces formadas in vitro se caracterizan en general, por ser fisiológicamente poco eficientes y funcionales debido a la fácil hidratación y nutrición de los tejidos a partir del medio de cultivo. Prameela (2018) reporta que Nemeth (1986) y Gaspar y Coumans (1987) consideran que tradicionalmente, los brotes se micropropagan sujetos a un enraizamiento in vitro para la producción de la planta, sin embargo, este método a menudo produce raíces no funcionales y callos en la base, lo que resulta en una mala conexión vascular entre el brote y la raíz. Abdelnour y Muñoz (2005) citan a Monteuus et al. (1998) diciendo que no es necesario utilizar sustancias enraizadoras cuando los materiales son sembrados en condiciones climáticas favorables para el crecimiento de la especie. Hurtado (1991) citado por Quintero et al. (2003), recomienda que las plantas deben de tener de dos a tres nudos y un sistema radicular desarrollado para ser transplantadas al suelo.
Vigor de plantas de segmentos de tallos con dos entrenudos sin yema apical. El mejor vigor de planta se logró en los medios de cultivos que contenían 0.25, 0.50 y 0.75 mg L-1 de AIA con valores entre 60 % y 70 %, mientras que con el medio de cultivo con 1.00 mg L-1 de AIA se registra el mayor porcentaje de plantas con bajo vigor (30 %) (Figura 13). Lograr que en la fase de enraizamiento se obtengan plantas con buen vigor, permite que en el proceso de aclimatación se obtenga mayor sobrevivencia, debido a que un buen desarrollo de raíces facilita una mejor nutrición de las plantas respecto aquellas de bajo vigor.
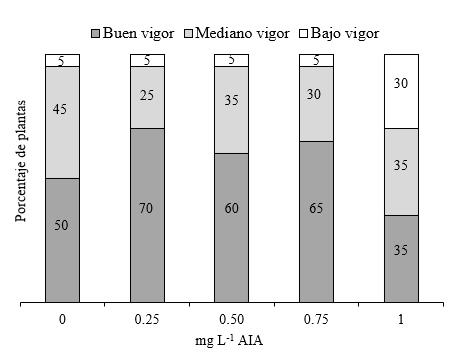
La longitud de planta, número de hojas producidas y el vigor obtenido en la fase de enraizamiento, resultan superiores a los valores obtenidos en las primeras dos fases de multiplicación; posiblemente debido a que la teca respondió mejor fisiológicamente al Ácido Indol Acético que a las combinaciones de 6-BAP con GA3.
Las ventajas de los sistemas de inmersión en medio líquido sobre la micropropagación tradicional es el resultado de las condiciones físicas creadas en el biorreactor, como son: aporte más eficiente de los elementos nutritivos, mínima interrupción del intercambio de gases entre el explante o embrión y la atmósfera, la no existencia de acumulación excesiva de gases nocivos para los tejidos y la dispersión de los tejidos por efecto del flujo de aire en el recipiente (Pérez et al., 1998).
CONCLUSIONES
Con adición de 1.00 mg L-1 de 6-BAP y 0.10 mg L-1 de GA3 el promedio de número de hojas producidas resultó mejor con el empleo de yemas apicales individuales y segmentos de tallos con un entrenudo sin yema apical; mientras que con yemas apicales con dos o tres entrenudos fue en el medio de cultivo que contenía 0.50 mg L-1 de 6-BAP combinado con 0.05 o 0.10 mg L-1 de GA3.
Con densidad de siembra de 30 yemas apicales con dos entrenudos y densidad de 40 yemas apicales o axilares se logró la mejor respuesta en el número de hojas.
Con yemas apicales y axilares con dos entrenudos, las variables longitud del tallo, número de hojas y número de raíces, presentan similar comportamiento con las adiciones de 0.25 mg L-1, 0.50 mg L-1 y 0.75 mg L-1 de ácido indol acético, además la categoría de buen vigor se obtiene en mayor porcentaje (60 % - 70 %) con el uso de estas variantes de medio de cultivo.
REFERENCIAS BIBLIOGRÁFICAS
Abdelnour, A. y Muñoz, A. (2005). Micropropagación de (Tectona grandis L. F.). Kurú Revista Forestal (Costa Rica), 2(5), 1-11. https://repositoriotec.tec.ac.cr/bitstream/handle/2238/7222/Micropropagacion_teca.pdf?sequence=1&isAllowed=y
Aguilar, M. E., Garita, K., Kim, Y. W., Kim, J. A. & Moon, H. K. (2019). Simple Protocol for the micropropagation of teak (Tectona grandis Linn.) in semi-solid and liquid media in RITA® Bioreactors and ex vitro rooting. American Journal of Plant Sciences, 10, 1121-1141. https://www.scirp.org/pdf/AJPS_2019071114343836.pdf
Allccaco Cuya, J. J. (2016). Estandarización de un medio de cultivo para la propagación clonal in vitro de Rubus idaeus var. Heritage “frambuesa roja” de importancia comercial [Tesis de Licenciatura, Universidad Ricardo Palma]. Repositorio Institucional. https://repositorio.urp.edu.pe/bitstream/handle/20.500.14138/1009/Allccaco_jj.pdf?sequence=1
De Camino Venoza, R. (2018). Diagnóstico del sector forestal en nicaragua: movilizando el sector forestal y atrayendo inversiones. https://publications.iadb.org/es/diagnostico-del-sector-forestal-en-nicaragua-movilizando-el-sector-forestal-y-atrayendo-inversiones
Castillo A., Ashfield R., Bentancor M., Bentancor L., Bonilla M. B., Ceppa M., Franco, R., Silva, N., Cabrera, D., Rodríguez, P. y Zoppolo, R. (2019). Micropropagación de plantas en biorreactores de inmersión temporal (BIT). Revista INIA, 56, 88-91. http://www.ainfo.inia.uy/digital/bitstream/item/12606/1/Revista-INIA-56-biotec.pdf
Castro R, D., Díaz G, J. y Linero J. C. (2002). Propagación clonal in vitro de árboles élite de teca. (Tectona grandis L.). Revista Colombiana de Biotecnología, 4(1), 49-53. https://revistas.unal.edu.co/index.php/biotecnologia/article/view/30089
Cruz Cardona, R. Y. (2020). Embriogénesis somática con explantes foliares de Coffea arabica cv. centroamericano y Coffea canephora cv. Conilon [Tesis de maestría, Universidad Nacional Agraria]. Repositorio Institucional. https://repositorio.una.edu.ni/4395/1/tnf62c957.pdf
Daquinta, M., Ramos, L., Capote, I., Lezcano, Y., Rodríguez, R., Trina, D. y Escalona, M. (2001). Micropropagación de la teca (Tectona grandis L. F.). Revista Forestal Centroamericana, 10(35), 25-28. https://repositorio.catie.ac.cr/bitstream/handle/11554/10038/Micropropagaci-n.pdf?sequence=1&isAllowed=y
Fonseca González, W. (2004). Manual para productores de Teca (Tectona grandis L. F) en Costa Rica. https://es.scribd.com/document/93107452/Manual-Productores-Teca-Costa-Rica-pdf
Prameela, U. (2018). Micropropagation of teak (Tectona grandis L.) from nodal explant [Master of Science dissertation, Indian National Agricultural Research Institute]. Institutional Repository. https://krishikosh.egranth.ac.in/items/5ed55b0c-2ea5-406d-ade5-eddbf661485e
Polo Santos, J. M., Suarez Padrón, I. E. y Gatti, K. C. (2013). Micropropagación de Tectona grandis L. F. a partir de meristemos preexistentes. Temas Agrarios, 18(2), 83–93. https://doi.org/10.21897/rta.v18i2.718
Pérez Ponce, J. N., Jiménez, E. y Agramonte, D. (1998). Aumento de la eficiencia de la propagación masiva: en propagación y mejora genética de las plantas por biotecnología. Universidad Central de las Villas.
Quintero, I., Polo, J., Jarma, A. y Espitia, A. (2003). Enraizamiento in vitro de Dioscorea sp. Revista Colombiana de Biotecnología, 5(2), 51-56. https://revistas.unal.edu.co/index.php/biotecnologia/article/view/575
Rodríguez Anda, R., Zamora Natera, J. F., Silva Guzmán, J. A., Salcedo Pérez, E. y Fuentes Talavera, F. J. (2014). Propiedades físico-mecánicas de madera de teca de plantaciones comerciales. Revista mexicana de Ciencias Forestales, 5(24), 12-25. https://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2007-11322014000400003
Rojas Parajeles, F. y Abdelnour Esquivel, A. (2012). Brotación in vitro de yemas de teca (Tectona grandis L. f.). Tecnología en Marcha, 25(5), 67-72. https://revistas.tec.ac.cr/index.php/tec_marcha/article/view/475/403
Notas de autor

