



Ciencia de las Plantas
Nematodos fitoparásitos asociados al cultivo de guayaba (Psidium guajava L.) en parcela manejada con enfoque agroecológico
Phytoparasitic nematodes associated with Guava (Psidium guajava L.) crop in agroecologically managed plots
La Calera
Universidad Nacional Agraria, Nicaragua
ISSN: 1998-7846
ISSN-e: 1998-8850
Periodicidad: Semestral
vol. 24, núm. 42, 2024
Recepción: 31 Mayo 2023
Aprobación: 29 Mayo 2024
Resumen: Los nematodos fitoparasitos provocan necrosis, descortezamiento y pudriciones suaves en los tejidos corticales (sistema radicular) en diversos cultivos de importancia económica, social y ambiental. El objetivo de este estudio fue identificar los géneros de nematodos fitoparasitos asociados al cultivo de guayaba en una parcela manejada con enfoque agroecológico. Este trabajo se realizó en la Universidad Nacional Agraria, en Managua, Nicaragua. En la parcela con enfoque agroecológico se realizó el muestreo de suelos y raíces para la identificación de los géneros de nemátodos. El muestreo de suelo y raíces se realizó con un barreno graduado y a una profundidad de 0 cm a 15 cm. Se obtuvieron 10 submuestras al azar por árbol en el área de goteo; las submuestras se homogenizaron para obtener una muestra de 1 kg de suelo y 10 gramos de raíces. Los nematodos del suelo se extrajeron por el método de centrifugación flotación y los del sistema radicular por el método de embudo de Berman. Los nematodos se identificaron a nivel de género mediante microscopía de luz, caracteres morfológicos y claves taxonómicas propuesta por S' Jacob y Bezooijen (1984). Los datos fueron ingresados a una hoja de cálculos de Microsoft Excel con el que se determinó la frecuencia absoluta y relativa. Las poblaciones se determinaron a través del conteo de los individuos. Se identificaron cinco familias y diez géneros de nematodos en muestra de suelos y raíces, asociados como especies fitoparásitos al cultivo de guayaba, mayoritariamente con hábito alimenticio ectoparásito.
Palabras clave: Meloidogyne, Pratylenchus, Helicotylenchus, ectoparásito, hábito alimenticio, agroecología.
Abstract: Phytoparasitic nematodes cause necrosis, bark splitting, and soft rot in the cortical tissues (root system) of various economically, socially, and environmentally important crops. The objective of this study was to identify the genera of phytoparasitic nematodes associated with guava cultivation in an agroecologically managed plot. This research was conducted at the Universidad Nacional Agraria, in Managua, Nicaragua. In the agroecological plot, soil and root sampling were performed to identify the nematode genera. Soil and root samples were collected using a graduated auger at a depth of 0 cm to 15 cm. Ten random sub-samples were taken per tree within the drip area, and these sub-samples were homogenized to obtain a composite sample of 1 kg of soil and 10 grams of roots. Soil nematodes were extracted using the centrifugation-flotation method, while root nematodes were extracted using the Berman funnel method. Nematodes were identified at the genus level using light microscopy, morphological characters, and taxonomic keys proposed by S’ Jacob and Bezooijen (1984). Data were entered into a Microsoft Excel spreadsheet, where absolute and relative frequencies were determined. Populations were assessed through individual counts. Five families and ten genera of nematodes were identified in soil and root samples, predominantly as ectoparasitic species associated with guava cultivation.
Keywords: Meloidogyne, Pratylenchus, Helicotylenchus, ectoparasite, feeding habit, agroecology.
La guayaba (Psidium guajava L.) es una fruta originaria de Mesoamérica, se desarrolla en el trópico y aporta nutrientes a cientos de millones de personas; es preferida por su sabor y alto contenidos de vitaminas C (200-500 mg 100 g-1 de fruta) y vitamina A (250-400 mg 100 g-1 de fruta) (Bogantes-Arias y Mora-Newcomer, 2010). En Nicaragua este cultivo es producido por pequeños productores. Por ser un cultivo perenne, presenta problemas de plagas y enfermedades.
El rendimiento y calidad del fruto son afectados por plagas insectiles, enfermedades fúngicas y nematodos fitoparásitos, constituyendo una limitante para la producción y soberanía alimentaria de millones de personas (Talavera et al., 2014).
Moosavi (2012) indica que a nivel mundial los nematodos fitoparásitos causan pérdidas entre 5 % y 12.3 % en los trópicos; Avelar et al. (2003) reportan 28 géneros asociados a cultivares, entre ellos Meloidogyne spp., Rotylenchulus spp., Pratylenchus spp., Hoplolaimus spp., Tylenchorhynchus spp. y Helicotylenchus spp., en cambio González (2009), refiere que el género de mayor importancia en el cultivo de guayaba es Meloidogyne, nematodo que ocasiona daños en las raíces en forma de agallas o nódulos (cámaras de alimentación) que forma la hembra para su reproducción, daño que impide la traslocación de nutriente y formación de raíces de absorción, perjudicando el crecimiento y desarrollo de las plantas y el fruto, así como la calidad organoléptica.
Otros daños reportados son los ocasionados por Pratylenchus sp., quien afecta las raíces al alimentarse del contenido celular y provocar su descortezamiento, daño que se manifiesta como clorosis, marchites y defoliación de las plantas (Lugo et al., 2007).
Guzmán y Castaño (2010); Hernández y Hernández (2006) identificaron a los géneros Meloidogyne, Pratylenchus y Helicotylenchus como género fitoparasitos asociados al cultivo de guayaba; Pereira et al. (2018) también reportan a Meloidogyne y Pratylenchus como género de importancia agrícola en la producción de este cultivo, colonizando el sistema radicular.
En Nicaragua no existe un registro de poblaciones de nematodos fitoparasitos asociado al cultivo de guayaba, que podrían afectar el crecimiento, rendimiento y calidad de los frutos, por lo que el objetivo de esta investigación es identificar géneros de nematodos que producen afectaciones en el cultivo de guayaba.
MATERIALES Y MÉTODOS
Ubicación y descripción de la parcela
Esta parcela tiene un propósito experimental y académico, se encuentra ubicada en la Universidad Nacional Agraria (UNA) en el km 12.5 Carretera Norte, en Managua, capital de Nicaragua. La parcela se localiza en las coordenadas geográficas de 12°08´36´´ de latitud Norte y 86°09´49´´ de longitud Oeste. La variedad establecida es Taiwán 1, que se caracteriza según Hernández y Tinoco (2017) por producir frutos de buen tamaño, redondos de color verde y mesocarpio grueso de color crema.
La parcela presenta un sistema de siembra a tres bolillos con distanciamiento de tres metros entre planta y tres metros entre surco para una población de 190 plantas. El área de la parcela es de 0.43 hectáreas. El manejo agronómico estuvo a cargo del responsable de la parcela y consistió en un manejo con enfoque agroecológico, entre las actividades de manejo estuvieron (control de maleza, riego, poda fitosanitaria y poda de fructificación).
El propósito de la parcela fue suministrar las muestras de suelo y raíces para la identificación de los géneros de nemátodos, determinación que se realizó en el laboratorio de nematología agrícola de la UNA. El período del estudio fue de abril a agosto del 2022.
Colecta de muestras
El muestreo se realizó entre las 7:00 am y las 9:00 am con la ayuda de un barreno graduado a una profundidad de 0 cm a 15 cm. Se obtuvieron 10 submuestras al azar; una por árbol y extraídas en el área de goteo; las submuestras se homogenizaron para obtener una muestra de 1 kg de suelo y 10 gramos de raíz, las que se colocaron en bolsas plásticas debidamente rotuladas y depositadas en un termo con hielo para su traslado al laboratorio de Nematologia agrícola de la UNA. En total se colectaron 16 muestras de suelo y raíz.
Extracción de nematodos del suelo
Se utilizó el método de centrifugación flotación propuesto por Herrera y Bijlmakers (1993) que consiste en homogenizar un kilogramo de suelo, del que se utilizan 200 gramos y se decanta en 1.5 litros de agua sin cloro, posteriormente se homogeniza con la ayuda de una espátula metálica y se deja reposar por 30 segundo, para ser decantado en un juego de tamices (0.425, 0.25, 0.1 y 0.045 mm de diámetro del poro), repitiendo el proceso dos veces consecutivas; el sedimento obtenido de los primeros dos tamices superiores (0.425 y 0.25 mm) se lavan con una pizeta sobre los tamices últimos de menor diámetro (0.1 y 0.045 mm) y se decantan en vasos de centrifuga para su centrifugación por un periodo de cinco minutos a una velocidad 3 000 revoluciones por minuto (rpm), luego se decanta el sobrenadante y se aplican 20 ml de solución azucarada con una densidad de 1.18 g cm3, se homogeniza y luego se coloca en los vasos de centrifuga a una velocidad 3 000 rpm, el sobrenadante se colecta en el tamiz de 0.01 mm y se realiza un lavado con agua sin cloro para eliminar la solución azucarada y se coloca en las gradillas de conteo para su identificación y conteo de poblaciones.
Extracción de nematodos de raíz
Las muestras se procesaron por el método de embudo de Berman propuesto por Herrera y Bijlmakers (1993), consiste en lavar 30 gramos de raíces con abundante agua sin cloro (agua en reposo por 24 horas) de este se toman 10 gramos y se cortan en trozos de 10 cm con una tijera; estos se descantan en un vaso de licuadora de dos velocidades y se agregan 100 ml de agua libre de cloro para su trituración por 15 segundos por velocidad, luego se descanta en una bandeja metálica cubierta con papel toalla para ser colocada en un plato con 200 ml de agua para incubación durante 72 horas, posteriormente se decanta en un el sobrenadante en un biker para su respectivo conteo de géneros de nemátodos.
Identificación de nematodos
Los nematodos se identificaron a nivel de género mediante microscopía de luz, caracteres morfológicos y claves taxonómica propuesta por S' Jacob y Bezooijen (1984).
Análisis de datos
Los datos fueron ingresados a una hoja de cálculos de Microsoft Excel 2016, donde se determinó la frecuencia absoluta y relativa según las fórmulas propuestas por Balzarini et al. (2015).


RESULTADOS Y DISCUSIÓN
Nematodos asociados a guayaba
Se identificaron cinco familias y diez géneros de nematodos fitoparásitos en muestra de suelos y raíces (Cuadro 1).
| Clase | Orden | Familia | Género | Hábito alimenticio |
| Secernentea | Tylenchida | Tylenchida | PratylenchusRotylenchulus Tylenchus Paratylenchus | Ectoparásito migratorio Ectoparásito Semi endoparásitos sedentarios Ectoparásito |
| Heteroderidae | Meloidogyne | Endoparásito sedentario | ||
| Criconematidae | Criconemoides | Ectoparásito sedentario | ||
| Hoplolaimidae | Rotylenchus Helicotylenchus | Semi endoparásitos sedentarios Semi endoparásitos migratorios | ||
| Scutellonema | Ectoparásitos | |||
| Adenophorea | Dorilaymidae | Dorilaymidae | Xiphinema | Ectoparásito migratorio |
Estos diez géneros por su hábito alimenticio se asocian como fitoparáistos del cultivo de guayaba. Guzmán y Castaño (2010) identifican los géneros Meloidogyne, Helicotylenchus y Pratylenchus asociados a este cultivo; en cambio Gandarilla et al. (2014) se refieren a 60 especies, de las cuales, el género de mayor importancia, en cuanto a la incidencia y daño, es Meloidogyne spp. (Figura 1).
Género de nematodos asociados al suelo
En la Figura 1 se presentan nueve géneros asociados a las muestras del suelo, indicando menor cantidad de nematodos los del género Paratylenchus.
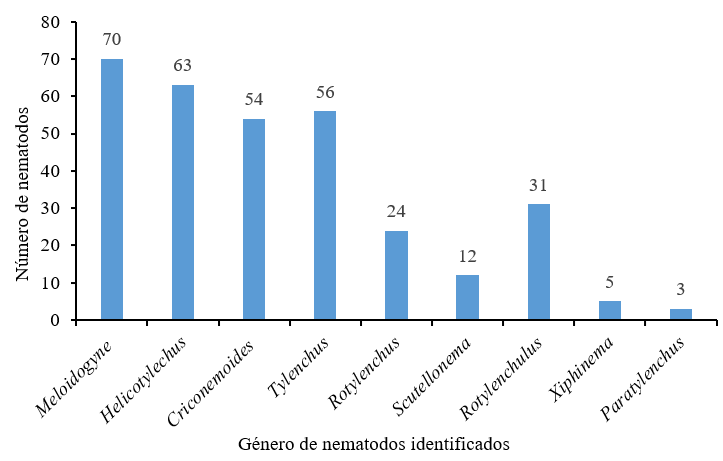
De estos nueve géneros, Madhu et al. (2019) reportan como agentes fitoparásitos de la guayaba a Meloidogyne incógnita, Rotylenchulus reniformis, Helicotylenchusspp y Xiphinema; en cambio Nayba et al. (2012) así como Castellano et al. (2012), reportan a Rotylenchulus y Paratylenchus.
La identificación de estos géneros y sus hábitos alimenticios permite orientar un manejo agroecológico orientado al mantenimiento de la sostenibilidad del sistema. Baños et al. (2010) encontraron un efecto positivo sobre la reducción de la infestación de nematodos fitoparasitos usando gallinaza y melaza, lo que permite incorporar nutrientes al suelo y liberación de sustancias nematicidas, favoreciendo la salud y calidad del suelo, en cambio Araya et al. (2014) reportan que uno de los principales factores limitantes en la salud del sistema radicular es la presencia de nematodos fitoparásitos, lo que puede representar entre 5 % y 9 % de los costos de producción. Bulluck et al. (2002) registran que, con el uso de enmiendas orgánicas en sistemas agroecológicos, se promueve el incremento de microorganismos benéficos que disminuyen los efectos de los organismos holobiontes (en este caso, fitopatógeno) que afectan el sistema radicular y la salud del suelo.
Género de nematodos asociados a raíz
Ocho géneros de nematodos fitoparasitos se encontraron en el sistema radicular y nueve en el sistema suelo. La mayor población pertenece al habito alimenticio ectoparásito.
Se observó que los géneros Meloidogyne y Tylenchus presentan las mayores poblaciones y que los géneros Xiphinema, Helicotylenchulus y Rotylrnchulus registran las menores poblaciones (Figura 2).
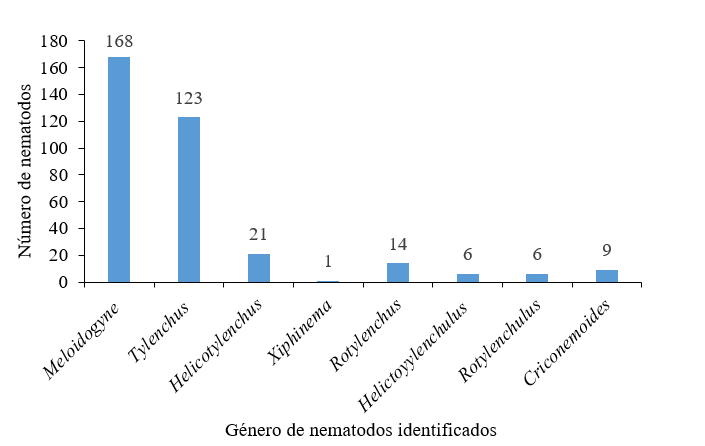
Los géneros Meloidogyne y Tylenchus registran las mayores poblaciones y los géneros Xiphinema, Helicotylenchulus, Rotylenchulus y Criconemoides fueron los que presentaron las menores poblaciones (Figura 2).
El género Meloidogyne es un fitoparásito polífago con una amplia distribución en todo los cultivares a nivel mundial y gran capacidad de interacción con otros fitopatógenos, incluidos géneros de nematodos, hongos y bacterias causando pérdidas en la agricultura (Moens et al., 2009).
Guzmán y Castaño (2010) y Madhu et al. (2019) refieren que Meloidogyne presenta las mayores densidades poblacionales en el cultivo de guayaba, dato que coincide con los resultados en este estudio. En cambio, Apreza y Roa (2001) reportan a los géneros Rotylenchulus, Helicotylenchulus y Criconemoides afectando raíces de guayaba.
Peraza (2010) afirman la importancia de la actualización de los géneros de nematodos por cultivos y zonas geográficas, caracterizando la patogenicidad y ecología de los géneros para un manejo sostenible de sus poblaciones.
Los resultados en esta investigación son relevantes para la contextualización de los géneros de nematodos asociados al cultivo de guayaba, siendo una fruta comercial de importancia para pequeños y medianos productores de Nicaragua.
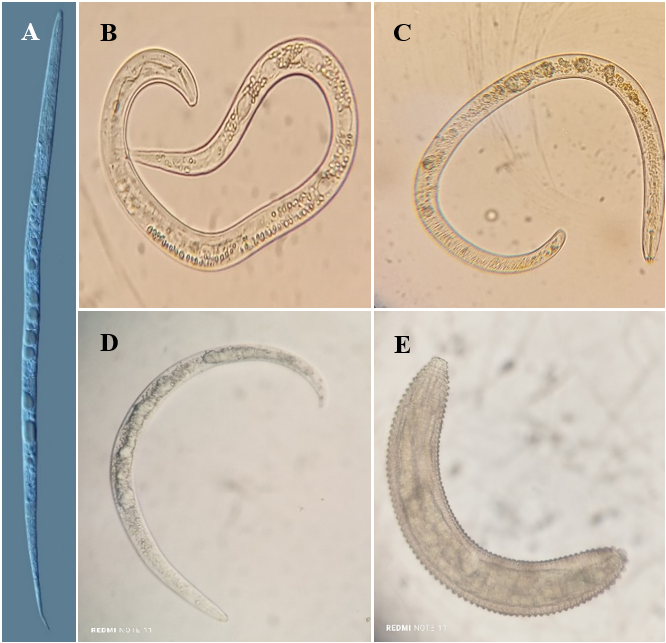
En la Figura 3 se observan los nematodos de mayor población en raíces.
Frecuencia absoluta y relativa por género
Se registró una población total de 666 nematodos fitopatógenos. Los géneros de nematodos con la mayor frecuencia absoluta (porcentaje del género asociado al número total de muestra) fue Meloidogyne y Criconemoides seguido de Tylenchus y Helicotylenchus, en cambio el género con los menores porcentajes de frecuencia absoluta y relativa fue Paratylenchus y Xiphinema. La mayor frecuencia relativa (porcentaje del género asociado al total de géneros registrados) se presenta con el género Meloidogyne seguido de Tylenchus y Criconemoide (Cuadro 2).
| Género de nematodos | Número de individuos | FA (%) | FR (%) |
| Meloidogyne | 70 | 68.75 | 22.01 |
| Tylenchus | 56 | 43.75 | 17.60 |
| Helicotylenchus | 63 | 25.00 | 7.86 |
| Criconemoides | 54 | 68.75 | 17.00 |
| Xiphinema | 5 | 6.25 | 1.57 |
| Rotylenchus | 24 | 18.75 | 7.54 |
| Scutellonema | 12 | 12.50 | 3.77 |
| Rotylenchulus | 31 | 12.50 | 9.74 |
| Paratylenchus | 3 | 6.25 | 0.94 |
FA: Frecuencia absoluta, FR: Frecuencia relativa.
Chávez (2014) reporta a Meloidogyne como el género con las poblaciones más altas, también indica una frecuencia absoluta similar a la registrada para el género de Helicotylenchus en la parcela con enfoque agroecológico, por su parte Madhu et al. (2019) reportan una frecuencia absoluta para Meloidogyne incognita de 72.2 %, 63.2 %, 56.3 % y 53.3 % en distintos distritos de la India.
La presencia de nemátodos en la parcela de guayaba también podría estar asociado al historial de cultivos establecidos, los que tienen una relación directa con la presencia de estas especies, por ejemplo, en años anteriores se ha cultivado plátano (Musa paradisiaca L), papaya (Carica papaya L.) y piña (Ananas comosus L.). Lara et al. (2016) exponen que: “Los nematodos fitoparásitos constituyen uno de los principales problemas fitosanitarios que afectan el cultivo de plátano a nivel mundial” (p. 116). En el caso del cultivo de piña, Vera et al. (2016), reportan a los géneros Helicotylenchus, Tylenchus, Meloidogyne y Pratylenchus presentes en muestras de raíces. Estos mismos géneros fueron reportados por Jiménez et al. (2001), como los de mayor abundancia asociados al cultivo de piña. Condori et al. (2021) reportan a estos mismos géneros como especies presentes en el cultivo de papaya, así como a Xiphinema.
Los resultados obtenidos entre estos autores y los de este estudio, se relaciona con el hábitos alimenticios de estos nematodos, los que se encuentran en una alta variedad de cultivares y considerados como potencial plaga en cultivos de importancia económica.
CONCLUSIÓN
Los géneros Meloidogyne, Tylenchus, Helicotylenchus, Xiphinema, Rotylenchus, Helicotylenchulus, Rotylenchulus, Criconemoides, Scutellonema y Paratylenchus, están asociados como especies fitoparásitos al cultivo de guayaba en la parcela manejada con enfoque agroecológico, sin embargo, Scutellonema y Paratylenchus por su comportamiento y hábito alimenticio, son detectados únicamente en las muestras de suelo.
Agradecimientos
A la Universidad Nacional Agraria por financiar esta investigación y permitir el uso de la parcela agroecológica y las instalaciones del laboratorio de nematología agrícola.
REFERENCIAS BIBLIOGRÁFICAS
Apreza García, R. C. y Roa Noriega, S. K. (2001). Identificación y estudio de la dinámica poblaciones de la nematofauna asociada a cultivares de guayaba (Psidium guajava L.) en el municipio zona bananera, departamento del Magdalen [Tesis de Ingeniería, Universidad del Magdalena]. Repositorio Institucional http://repositorio.unimagdalena.edu.co/handle/123456789/2517
Avelar Mejía, J. de J., Cárdenas Soriano, E., Téliz Ortiz, D. y Cid del Prado Vera, I. (2003). Efecto del declinamiento del guayabo en la anatomía de rama y raíz de Psidium guajava L. Revista Mexicana de Fitopatología, 21(3), 309-315. https://www.redalyc.org/pdf/612/61221311.pdf
Balzarini, M., González, L., Tabalado, E., Casanoves, A. y Di Rienzo, C. (2015). Infostat manual del usuario. https://repositorio.catie.ac.cr/bitstream/handle/11554/10346/Manual_INFOSTAT_2008.pdf?sequence=1
Baños, Y. S., Concepción, A. D. B., Lazo, R. C., González, I. A. y Morejón, L. P. (2010). Efecto de enmiendas orgánicas y Trichoderma spp. en el manejo de Meloidogyne spp. Revista Brasileira de Agroecología, 5(2), 224-233. https://orgprints.org/id/eprint/24512/1/Ba%C3%B1os_Efecto.pdf
Bogantes-Arias, A. y Mora-Newcomer, E. (2010). Evaluación de cuatro patrones para injertos de guayaba (Psidium guajava L.). Agronomía mesoamericana, 21(1), 103-111. https://doi.org/10.15517/am.v21i1.4916
Bulluck L. R., Brosius M., Evanylo, G. K. & Ristaino, J. B. (2002). Organic and synthetic fertility amendments influence soil microbial, physical and chemical properties on organic and conventional farms. Applied Soil Ecology, 19(2), 147-160. https://www.sciencedirect.com/science/article/abs/pii/S0929139301001871
Castellano, G., Casassa-Padrón, A. M., Ramírez-Méndez, R., Pérez-Pérez, E., Burgos, M. E. y Crozzoli, R. (2012). Nematodos fitoparásitos asociados a frutales estratégicos en el municipio Baralt del estado Zulia, Venezuela. Fitopatología Venezolana, 25(1), 2-6. https://www.cabidigitallibrary.org/doi/pdf/10.5555/20133097399
Chávez, M. (2014). Densidad y diversidad de nematodos fitoparásitos y de suelo en sistemas orgánicos y convencionales de café en asocio con banano en el Valle Central y Occidental de Costa Rica. Periodo 2013-2014 [Tesis de maestría, Centro Agronómico Tropical de Investigación y Enseñanza]. Repositorio institucional. https://repositorio.catie.ac.cr/handle/11554/7122
Condori, G. B. C., Medina, I. L., Portocarrero, R. Y. B., Tito, K. B., & Coila, V. H. C. (2021). Nematodes associated with Andean papaya (Carica pubescens L.) in Sandia district, Puno, Perú. Bioagro, 33(3), 191-202. https://dialnet.unirioja.es/servlet/articulo?codigo=8135615
Gandarilla Basterrechea, H., Rivas Bofill, O. y Fernández Gonzálvez, E. (2014). Fitonemátodos asociados a los cultivos de frutos tropicales. Fitosanidad, 18(3), 187-197. https://www.redalyc.org/pdf/2091/209143451009.pdf
González Gaona, E., Velásquez Valle, R., Perales de la Cruz, M. A. y Sánchez Lucio, R. (2009). Nematodos asociados con el cultivo de guayabo. En E. González Gaona (Ed.), Identificación y control de nematodos que afectan al cultivo del guayabo en México (pp. 37-62). https://www.academia.edu/27956049/Identificaci%C3%B3n_y_control_de_nematodos_que_afectan_al_cultivo_del_guayabo_en_M%C3%A9xico
Guzmán Piedrahita, O. A. y Castaño Zapata, J. (2010). Identificación de nematodos fitoparásitos en guayabo (Psidium guajava L.), en el municipio de Manizales (Caldas), Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 34(130), 117-125. https://xdoc.mx/preview/identificacion-de-nematodos-fitoparasitosen-5c2fbda44b3b4
Hernández Cruz, G. K. y Tinoco Arteta, J. K. (2017). Producción y comercialización de la guayaba taiwanesa en el municipio La Concordia departamento de Jinotega. Periodo 2013-2016 [Tesis de Licenciatura, Universidad Nacional Autónoma de Nicaragua, Managua]. Repositorio Institucional. https://repositorio.unan.edu.ni/4839/1/17809.pdf
Hernández Hernández, R., Vallín, G del. y Hernández, D. (2006). Diagnóstico de fitonematodos en suelos de cultivos frutales. Fitosanidad, 10(4), 261-264. https://www.redalyc.org/pdf/2091/209116183002.pdf
Herrera, I. y Biljmakers, H. (1993). Manual de prácticas de nematología agrícola. Universidad Nacional Agraria.
Jiménez, N., Crozzoli, R., Petit, P. y Greco, N. (2001). Nematodos fitoparasiticos asociados con el cultivo de la piña, Anannas comosus, en los estados Lara y Trujillo, Venezuela. Nematol. Medit. 29, 13-17. https://www.google.com/url?sa=t&source=web&rct=j&opi=89978449&url=https://journals.flvc.org/nemamedi/article/view/86638/83554&ved=2ahUKEwjkjoHrvrOGAxVZTDABHVYsCoIQFnoECBYQAQ&usg=AOvVaw0dLIg2_L0fgflo_TkVI3he
Lara Posadas, S. V., Núñez Sánchez, Á. E., López-Lima, D. y Carrión, G. (2016). Nemátodos fitoparásitos asociados a raíces de plátano (Musa acuminata AA) en el centro de Veracruz, México. Revista Mexicana de Fitopatología, 34(1), 116-130. https://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0185-33092016000100116
Lugo, Z., Crozzoli, R., Perichi, G., Medina, R. y Castellano, G. (2007). Nematodos fitoparasíticos asociados a plantas cultivadas y silvestres en el municipio Miranda del estado Falcón, Venezuela. Fitopatología Venezolana, 20(1), 15-20. https://www.researchgate.net/publication/328368602_Nematodos_fitoparasiticos_asociados_a_plantas_cultivadas_y_silvestres_en_el_municipio_Miranda_del_Estado_Falcon_Venezuela/link/5bc9038ca6fdcc03c7939a34/download?_tp=eyJjb250ZXh0Ijp7ImZpcnN0UGFnZSI6InB1YmxpY2F0aW9uIiwicGFnZSI6InB1YmxpY2F0aW9uIn19
Madhu, M. R., Verma, K. K. & Vinod, K. (2019). Distribution, prevalence and intensity of guava decline in western Haryana. Journal of Entomology and Zoology Studies, 7(4), 521-524. https://www.entomoljournal.com/archives/2019/vol7issue4/PartI/7-4-39-134.pdf
Moens, M., Perry, R. N. y Starr, J. L. (2009). Meloidogyne species - a diverse group of novel and important plant parasites. En R. N. Perry, M. Moens, y J. L. Starr. (Eds.), Root-Knot Nematodes (pp. 1-17). https://www.researchgate.net/publication/281508596_Meloidogyne_species_-_a_diverse_group_of_novel_and_important_plant_parasites
Moosavi, M. R. (2012). Nematicidal effect of some herbal powders and their aqueous extracts against Meloidogyne javanica. Nematropica, 42(1), 48-56. https://journals.flvc.org/nematropica/article/view/79581
Nayba, N., Javed, N., Khan, S. A., Ullah, Z. & Khan, H. U. (2012). Estimation of prevalence and population densities of plant parasitic nematodes associated with twelve fruit trees in Pakistan. Pakistan Journal of Phytopathology, 24(1), 63-68. https://www.pjp.pakps.com/files/63-68-zia-paper.pdf
Peraza Padilla, W. (2010). Nematofauna asociada al cultivo de café (Coffea arábica) orgánico y convencional en Aserrí, Costa Rica. Ingenierías & Amazonia, 3(2), 105-112. https://www.uniamazonia.edu.co/documentos/docs/Facultades/Facultad%20de%20Ingenieria/Publicaciones/Revista%20ingenieria%20y%20amazonia/2010/Volumen%203%20No.%202/105-112.pdf
Pereira, K. C., Martins Soares, P. L., dos Santos, J. M. y de Carvalho Felisberto, P. A. (2018). Reação de cultivares de goiabeiras à Pratylenchus brachyurus. Summa Phytopathologica, 44(4), 386-390. https://repositorio.unesp.br/server/api/core/bitstreams/92cdab6c-6653-4ba2-ad67-e7c9bec08f54/content
S' Jacob, J. J. y Bezooijen, J. V. (1984). Practical work in nematology. Universidad Nacional Agraria
Talavera Rubia, M., Salmerón Parra, T., Chirosa-Ríos, M., Fernández Fernández, M. M. y Verdejo Lucas, S. (2014). Nematodos fitoparasitos en cultivos hortícolas. https://www.researchgate.net/publication/322386863_Nematodos_fitoparasitos_en_cultivos_horticolas
Vera Obando, N. Y., Maicelo Quintana, J. L., Guevara Heredia, E. y Oliva Cruz, S. M. (2016). Nematodos fitoparásitos asociados al cultivo de piña (Ananas comosus) en Amazonas, Perú. Scientia Agropecuaria, 8(1), 79-84. http://www.scielo.org.pe/pdf/agro/v8n1/a08v8n1.pdf
Notas de autor

