Probabilidades de Riesgo de Exposición al Mercurio en Comunidades Pesqueras de la Cuenca Grandes Lagos de Nicaragua
Risk Probabilities of Mercury Exposure in Fishing Communities in the Great Lakes Basin of Nicaragua
Francisco José Picado Pavón
Universidad Nacional Autónoma de Nicaragua, Managua. Centro para la Investigación en Recursos Acuáticos de Nicaragua, UNAN-Managua/CIRA, Nicaragua.
https://orcid.org/0000-0002-3698-5214
francisco.picado@cira.unan.edu.ni
Rommel José Lacayo Morales
Universidad Nacional Autónoma de Nicaragua, Managua. Centro para la Investigación en Recursos Acuáticos de Nicaragua, UNAN-Managua/CIRA, Nicaragua.
https://orcid.org/0000-0002-3585-6568
rommel.lacayo@cira.unan.edu.ni
Xaviera de Jesús Méndez Doña
Universidad Nacional Autónoma de Nicaragua, Managua. Centro para la Investigación en Recursos Acuáticos de Nicaragua, UNAN-Managua/CIRA, Nicaragua.
https://orcid.org/0000-0001-6568-2717
x.mendez@cira.unan.edu.ni
RECIBIDO
30/11/2023
ACEPTADO
03/07/2024
RESUMEN
La contaminación ambiental por mercurio (Hg) es altamente tóxica y resulta en el detrimento de los ecosistemas acuáticos, así como en efectos negativos en la salud humana. El objetivo de esta investigación fue evidenciar las probabilidades de riesgo que tienen las comunidades pesqueras de los Grandes Lagos de Nicaragua, al consumir pescado con Hg procedente de estos ecosistemas. Para esto fue necesario diagnosticar la presencia de mercurio en el Lago Cocibolca. Entre enero y junio de 2022, se procedió a la colecta de agua y sedimentos del lago, se adquirieron pescados de acopios locales, se analizaron los niveles de Hg en las aguas, sedimentos y pescado y se aplicaron encuestas a cuatro comunidades de la cuenca de los Grandes Lagos para obtener información sobre el consumo de pescado y datos antropométricos para el análisis del riesgo. Los resultados muestran una baja biodisponibilidad del Hg en los Grandes Lagos de Nicaragua, sin embargo, el contenido de Hg en los pescados analizados es superior al de pescados proveniente de ambientes no contaminados (<0,008) mg/kg. El contenido de Hg en los peces (0,008 a 0,475) mg Hg/kg es significativamente menor (p<0,0001, α =0,05) en el Lago Cocibolca. Afortunadamente, las probabilidades del riesgo asociada al consumo de pescado son bajas (<4,4%) para las comunidades estudiadas de la cuenca del Lago Cocibolca. Sin embargo, las probabilidades de riesgo para las comunidades pesqueras de la cuenca del Lago Xolotlán sugieren vigilar la inocuidad, en cuanto al contenido de Hg, de estos recursos hidrobiológicos.
PALABRAS CLAVES
Exposición; lago; mercurio; peces; riesgo.
ABSTRACT
Environmental contamination by mercury (Hg) is highly toxic and results in the detriment of aquatic ecosystems, as well as in negative effects on human health. The objective of this research was to demonstrate the risk probabilities that the fishing communities of the Great Lakes of Nicaragua have when consuming fish with Hg from these ecosystems. For this purpose, it was necessary to diagnose the presence of mercury in Lake Cocibolca. Between January and June 2022, water and sediments were collected from the lake, fish were acquired from local fish stocks, Hg levels in water, sediments and fish were analyzed, and surveys were applied to four communities in the Great Lakes basin to obtain information on fish consumption and anthropometric data for risk analysis. The results show a low bioavailability of Hg in the Great Lakes of Nicaragua, however, the Hg content of the fish analyzed is higher than that of fish from non-polluted environments (<0.008) mg/kg. The Hg content in fish (0.008 to 0.475) mg Hg/kg is significantly lower (p<0.0001, α =0.05) in Lake Cocibolca. Fortunately, the risk probabilities associated with fish consumption are low (<4.4%) for the studied communities in the Lake Cocibolca basin. However, the risk probabilities for the fishing communities of the Lake Xolotlán basin suggest monitoring the safety, in terms of Hg content, of these hydrobiological resources.
KEYWORDS
Exposure; lake; mercury; fish; risk.
INTRODUCCIÓN
El mercurio (Hg) se considera globalmente uno de los peores estresores de impacto antropogénico para el medio ambiente (Boening, 2000). Investigaciones sobre los efectos del Hg han demostrado el riesgo potencial que representa debido a su toxicidad, acumulación en la biota y su tendencia a biomagnificarse en los ecosistemas acuáticos, así como también por sus propiedades, movilidad ambiental, transformación en el medio ambiente, y efectos en la salud humana (Dórea & Marques, 2016).
Los Grandes Lagos de Nicaragua (ver Figura 1) cuentan con una alta producción y variedad de peces (Astorqui, 1976) que son el sustento para 33 comunidades dedicadas a la pesca artesanal. Desafortunadamente, la condición natural de estos ecosistemas ha sido alterada por el vertido de desechos industriales conteniendo metales como el mercurio (Hg) (Lacayo et al., 1991) y/o por fuentes naturales de este metal (MINSA et al., 2017). Sin embargo, estas mismas condiciones podrían propiciar la metilación del Hg y con ello, su acumulación en la ictiofauna.
La contaminación por Hg en los ecosistemas acuáticos es altamente persistente y su distribución se evidencia por la presencia de este metal neurotóxico (Grandjean et al., 1999; Yorifuji et al., 2013) en el agua, en los sedimentos y en la biota. Esta persistencia depende de la especiación química del Hg, de las características físicas y químicas del medio, así como de los mecanismos y procesos de transporte (Bale, 2000).
El Hg está en las aguas superficiales principalmente como Hg elemental (Hg0) y/o mercurio inorgánico (Hg2+) formando sales solubles. Su permanencia en este compartimiento, en su forma disuelta, es favorecida por la baja alcalinidad (pH < 7) y las bajas temperaturas del agua. Sin embargo, la presencia del Hg en las aguas también está asociada al material particulado en suspensión (Slotton et al., 2004), el cual es un sustrato para la retención del Hg. No obstante, esta asociación (Ravichandran, 2004) hace que el Hg sedimente dando lugar a que la fase sedimentaria albergue la mayor cantidad de este metal (Bale, 2000).
En los sedimentos, la acción bacteriana (Compeau & Bartha, 1985; Gilmour & Henry, 1991) y las condiciones oxido-reductoras (Li & Cai, 2013) dan lugar a que el mercurio en su forma iónica sea transformado a un Hg orgánico, principalmente a metilmercurio (MeHg o HgCH3+); este proceso se conoce como metilación. En esta forma química, el Hg tiene la capacidad de bioacumularse, por lo que los sedimentos se convierten en la fuente principal de Hg para los organismos acuáticos (Bale, 2000), y estos a su vez exponen a poblaciones humanas a los efectos tóxicos del mercurio.
Al igual que el resto de las sustancias químicas, el HgCH3+ producido principalmente en los sedimentos tiende a pasar a la columna de agua. Desde este compartimiento y cuando está en forma disuelta, el HgCH3+ atraviesa por difusión las barreras biológicas de los organismos acuáticos, quienes también se exponen al HgCH3+ a través del proceso de respiración e ingesta de alimento, dando lugar a la bioacumulación, la cual inicia con la asimilación del HgCH3+ por los organismos plantónico más diminutos y aumenta (biomagnificación) a través de la cadena trófica (biomagnificación) (Hina et al., 2021), siendo mayor en los organismos de los niveles superiores de la cadena.
Debido a la biomagnificación, los peces que son parte de la dieta alimenticia del ser humano alcanzan concentraciones de Hg hasta seis órdenes de magnitud superiores a las observadas en las aguas y sedimentos. Para algunas regiones del mundo, como en algunos ecosistemas europeos y en los Grandes Lagos de América del Norte, este escenario ha representado un riesgo de salud humana (Barone et al., 2022; Wright & Welbourn, 2002) y puede ser el mismo escenario para poblaciones de la cuenca de los Grandes Lagos de Nicaragua. El riesgo para la salud humana ha sido asociado a daños irreversibles en el sistema nervioso, trastornos neurológicos y cardiovasculares, entre otros.
La exposición humana al Hg a través del consumo de pescado contaminado ha sido ampliamente documentada y su acumulación en el cuerpo humano se ha asociado con alteraciones irreversibles del sistema nervioso. En los peces, el Hg entra principalmente por su alimento y por las branquias. Una vez que el Hg ha atravesado las branquias, es transportado por la sangre a varios tejidos, acumulándose principalmente en el hígado (Watras & Huckabee, 1994). Aunque la mayor parte del Hg al que están expuestos los peces es inorgánico, el MeHg es el que se encuentra en grandes cantidades en estos organismos, ya que la asimilación en los peces es bien baja (Lawson & Mason, 1998; Morel et al., 1998).
En el ser humano el Hg se encuentra principalmente en la sangre. Efectos adversos sobre el desarrollo neuronal en el ser humano durante su gestación y primeros años de vida también han sido atribuidos a la exposición al Hg (Cohen et al., 2005). Valores guías del contenido de Hg permitido en pescados de consumo para la protección al ser humano van desde 0,22 hasta 1,00 μg de Hg/g de pescado/semana. Por tanto, basado en estos valores guías, otras regiones del mundo han implementado programas para vigilar la inocuidad, en cuanto al contenido de Hg, de los recursos hidrobiológicos para su comercialización sostenible y para la seguridad alimentaria.
La exposición crónica al Hg y sus compuestos ha resultado en daño neurológico, parestesia (sensación de pinchazos, hormigueo o hormigueo en la piel), ataxia (incapacidad para coordinar movimientos musculares voluntarios que es síntoma de algunos trastornos nerviosos), alteración sensorial, temblores, pérdida de audición, visión borrosa (Cavalleri & Gobba, 1998), dificultades del habla, ceguera, sordera y muerte (Harada, 1995; Myers et al., 2000). Algunos de estos efectos han sido criterios de valoración de la neurotoxicidad en niños y mujeres que han consumido grandes cantidades de pescado contaminado con Hg durante el embarazo (Grandjean et al., 1999; Myers et al., 2000).
Las 33 comunidades pesqueras de la cuenca de los Grandes Lagos de Nicaragua son poblaciones reducidas y delimitadas geográficamente. Probablemente la residencia longeva de estas comunidades esté asociada a la disponibilidad del pescado, cuyo consumo y comercio han sido históricamente sus principales alternativas de subsistencia. Sin embargo los pobladores de estas comunidades desconocen que los pescados contienen mercurio y que este elemento es una neurotoxina que podría estar dañando su salud.
Por tanto, el objetivo de esta investigación fue evidenciar el riesgo de exposición al mercurio a través del consumo de pescado en comunidades pesqueras de los Grandes Lagos de Nicaragua. Consecuente, la presencia del mercurio en estos ecosistemas fue investigado como punto de partida para la estimación probabilística del riesgo. El conocimiento generado en esta investigación es la base científica para establecer acciones dirigidas a proteger la salud humana, así como es una contribución a la seguridad alimentaria y al inventario nacional de fuentes de Hg.
Materiales y métodos
El desarrollo de esta investigación fue orientada a la estimación probabilística del riesgo de exposición al Hg en pobladores de cuatro comunidades pesqueras de la cuenca de ambos lagos, sin embargo, fue necesario primeramente llevar a cabo un diagnóstico de los niveles de Hg en el Lago Cocibolca y su comparación con los niveles de Hg previamente diagnosticados en el Lago Xolotlán (MINSA et al., 2017).
La investigación tuvo un enfoque del tipo cuantitativo, ya que a través de la aplicación de la estadística se llevó a cabo la comprobación de algunas hipótesis siguiendo un razonamiento deductivo. También fue descriptivo y explicativo, dado que se diagnosticó el problema, su origen y consecuencias asociadas.
Como población de estudio se consideró la Cuenca de los Grandes Lagos (unidad hídrica, UH 69-952) incluyendo las 33 comunidades pesqueras existentes en la cuenca y como muestras el Lago Cocibolca y las comunidades pesqueras de San Francisco Libre (SFL), La Bocana de Tipitapa (LBT), San José del Lago (SJL) y San Jorge (SJ) (ver Figura 1).
En el caso de la colecta de muestras ambientales como agua y sedimentos (ver Figura 1), el tipo de muestreo fue intencional ya que esto permitió obtener muestras representativas del Lago Cocibolca mediante la inclusión de áreas de pesca frecuentadas por los pescadores. Mientras que, el muestreo para la adquisición de datos e información de poblaciones pesqueras fue aleatorio por conglomerados ya que estas se encuentran espacialmente dispersa en la cuenca de los Grandes Lagos (ver Figura 1). En la selección de estas comunidades se consideró criterios como: El consumo de pescado, no tener preferencia por un tipo de pescado, tiempo de residencia, edad entre los 6 y 95 años y que la comunidad estuviese concentra en un área relativamente pequeña.
Figura 1.
Mapa del área de estudio. Cuenca de los Grandes Lagos de Nicaragua. Enero-junio 2022.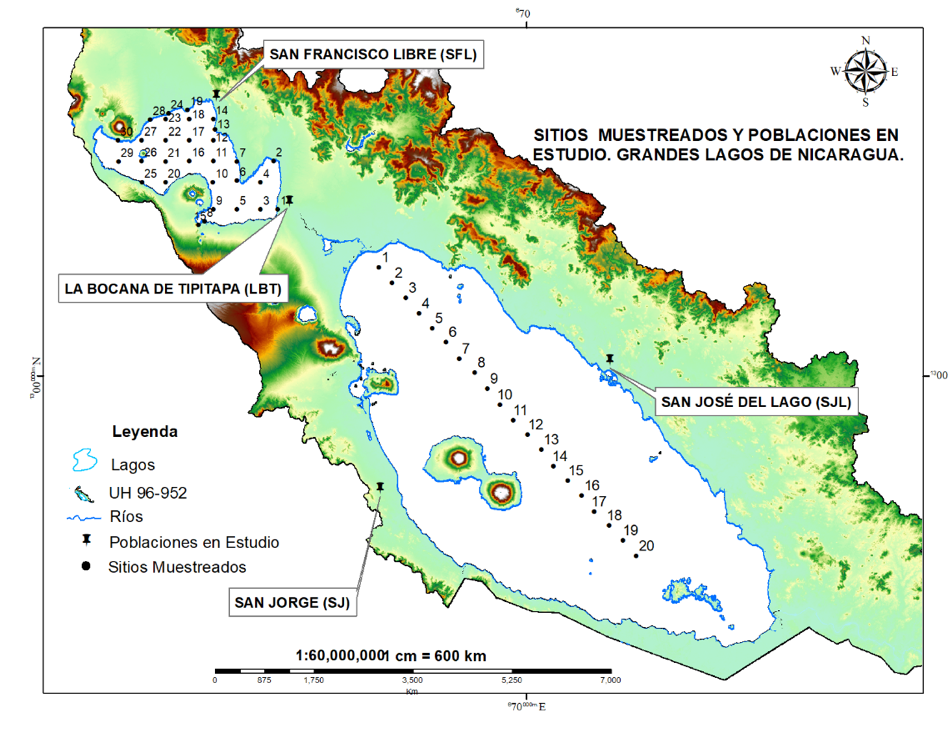
Nota: La figura muestra la ubicación de las cuatro comunidades pesqueras estudiadas y los sitios donde se colectaron muestras de sedimentos, agua superficial y de fondo. En estos mismos sitios, también se realizaron mediciones de variables de campo.
Etapas de la investigación
La investigación fue realizada cronológicamente de acuerdo con las siguientes etapas:
Etapa 1. Colecta de muestras de agua, sedimentos y mediciones de variables in situ
La colecta de muestras en el Lago Cocibolca fue ejecutada en una sola campaña, verano del 2022, sobre un transepto longitudinal de 114 km (ver Figura 1), conformado por 20 sitios equidistantes (6,0 km). En cada sitio fue colectada 1 muestra de agua superficial (AS), 1 de agua de fondo (AF) y 1 de sedimento superficial.
Las muestras de agua fueron colectadas con una botella Van Dorn Horizontal (Wildco ® Instruments, wildlife supply company), y las variables como el pH, Temperatura (T), Conductividad Eléctrica (CE), Oxígeno Disuelto (OD), Potencial Oxido Reductor (ORP) y Sólidos Totales Disueltos (STD) del agua fueron medidos simultáneamente con una sonda paramétrica (HANNA, HI 9828, pH/ORP/EC/DO). En tanto, los sedimentos fueron colectados con una draga Van Veen. Las muestras colectadas, agua y sedimento, fueron transportadas bajo refrigeración al laboratorio.
La profundidad y coordenadas de cada sitio fueron respectivamente medidas con una sonda medidor de profundidad SM-5, 40954 y un sistema de posicionamiento global (GPS, Garmin, Dakota 20). La información de campo de cada sitio y de custodia de las muestras fueron registradas in situ.
Etapa 2. Colecta de muestras de pescado
Una cantidad de 44 Guapotes (Parachromis managuensis, Parachromis dovii), 53 Mojarras (Amphilophus citrinellus, Archocentrus centrarchus) y 39 Guabinas (Gobiomorus dormitor) fueron comprados a acopios y/o a pescadores de las comunidades de SJL y SJ (ver Figura 1), y trasladados bajo refrigeración al laboratorio para su análisis.
Etapa 3. Análisis de mercurio en las aguas, sedimentos y pescados
Las concentraciones totales de Hg disuelto (biodisponible) (HgTD) y Hg particulado (HgTP) en las aguas y de Hg total (HgT) en los sedimentos fueron determinadas por Espectrometría de Absorción Atómica por Vapor Frío (EAA/VF), con un Analizador Automático de Hg, HG-201 (Límite de Detección, LD = 0,001 ng). Los límites de Cuantificación (LC) fueron de 0,015 ng/l y 0,003 µg/g. Blancos, Estándares Internos, Material de Referencia Certificado (CRM: IAEA-158), Estándares de Cuantificación, fueron analizados para el aseguramiento y control de calidad en los análisis.
Previo al análisis, los pescados fueron eviscerados, medidos sus pesos y sus tamaños y codificados. Una muestra de cada pescado fue removida de la parte dorsal próxima a la cabeza y posteriormente homogenizada. El 45% del total de las muestras fueron analizadas por duplicado por EAA en un Analizador Directo de Mercurio (MILESTONE INC, DMA-80; LD: 0,005 ng). Blancos y CRM (DORM II) fueron analizados simultáneamente.
Las concentraciones de metilmercurio (MeHg) en los pescados del Lago Cocibolca fueron estimadas asumiendo que la relación de HgT a MeHg (60 a 100) % es la misma que la observada en estas mismas especies del Lago Xolotlán. En estas especies, el contenido de MeHg (datos no reportados en este estudio) fue analizado por extracción con Ditizona en el 10% del total de cantidad de pescado (555) comprados en SFL y en LBT (Ver figura 1) (MINSA et al., 2017) y cuantificado por Cromatografía de Gases con Detector de Captura Electrónica (Agilent GC-µECD) (LC = 0,014 µg/g).
Etapa 4. Aplicación de encuestas
Las encuestas fueron dirigidas y aplicadas al 5,0% de pobladores consumidores de pescados de las comunidades de SJL, SJ, LBT y SFL (ver Figura 1), cuyas edades oscilaron entre 7 y 95 años.
Etapa 5. Análisis estadísticos y Análisis Probabilístico del Riesgo
El análisis estadístico fue llevado a cabo a través de pruebas de homogeneidad y normalidad para el grupo de datos de cada variable haciendo uso de los diferentes estadísticos como Shapiro-Wilk, Anderson-Darling, Pettitt y Von Neumann entre otros. Posteriormente fueron identificadas las correlaciones lineales entre variables en base a los coeficientes de Pearson para medir la relación estadística entre variables con un nivel de significancia del 95%. En tanto, posterior a las pruebas de normalidad y homogeneidad, la diferencia significativa reportadas entre el comportamiento de las variables fue realizada a través comparación de varianzas (F de Fisher, Levene, Bartlett) y pruebas t y z para muestras independientes.
El riesgo de exposición humana al Hg a través de la ingesta de pescado fue analizado, caracterizando la exposición y tomando como referencia los valores guías de Hg para el consumo seguro de pescado. En el análisis fue utilizado el Coeficiente de Amenaza (CA), el cual expresa la relación entre los niveles de exposición y los efectos en la salud humana expresados implícitamente por los valores guías, es decir:
CA = IDP (Ingesta Diaria Personal) /IDT (Ingesta Diaria Tolerable)
IDT: son los valores guías (0,10 a 0,50) µg MeHg/kg/día (PNUMA, 2005).
La exposición fue caracterizada conociendo la frecuencia, cantidad y especies de pescado consumida, tiempo de residencia y datos antropométricos de las poblaciones encuestadas. La esperanza de vida de los nicaragüenses fue tomada como cota límite de la exposición. Por tanto, la exposición al Hg fue estimada a través la IDP:
IDP = Porc × IP × Cp× Tres / (PC×E) y p(CA =1)(de Matos et al., 2021; Picado et al., 2010).
Donde: IDP: Ingesta Diaria Personal de Hg (µg/kg/día); Porc: Porcentaje de MeHg del contenido Hg Total en el pescado; IP: Ingesta de Pescado (g/día); Cp: Concentración de Hg Total en pescado (μg/g); PC: Peso Corporal (kg); Tresi: Tiempo de residencia (año); E: Esperanza de vida (75 años para la población nicaragüense según datos de la OMS).
Los datos sobre la exposición y los efectos fueron sometidos al análisis probabilístico del riesgo a través de Simulaciones Montecarlo (SMC) utilizando el software @Risk 7.5 (Palisade Inc.). las simulaciones fueron realizadas con una cantidad de 10 000 iteraciones a través del método de muestreo hipercubo latino (LHS). Para determinar las probabilidades del riesgo, el conjunto de valores de cada una de estas variables fue ajustado a una función de densidad probabilística (FDP).
El CA tiende a cero cuando la exposición es mucho menor que los efectos; es igual a uno cuando la exposición es igual a los efectos; y en cuanto más se aleje el CA al valor de uno, la exposición será superior a los efectos. Por tanto, al evaluar la probabilidad (p) (0-100) % de que el CA sea igual a 1 se está evaluando cualitativamente el riesgo y podemos asumir que:
Cuando la p(CA=1) es 0% el riesgo no existe. Sin embargo, cuando la p(CA=1) es mayor a 0% existe un riesgo potencial y será mayor cuanto mayor sea esa probabilidad.
RESULTADOS Y DISCUSIÓN
Los resultados de la investigación revelan los niveles de mercurio en los Grandes Lagos de Nicaragua en tres compartimientos: agua, sedimentos y pescado. El diagnóstico de la presencia de mercurio en este último compartimiento indica un riesgo relativamente alto para la salud de los pobladores de comunidades, cuya dependencia económica y fuente de proteína ha sido históricamente el comercio y consumo de pescado.
Mercurio en las aguas y sedimentos de los Grandes Lagos de Nicaragua
Las concentraciones de HgT en el Lago Cocibolca (ver Tabla 1), son similares a las observadas (0,300 a 8,000) ng/l en lagos y ríos libres de incidencia antrópica y de fuentes geológicas de Hg (Lindström, 2001; Watras et al., 2000). Consecuentemente las concentraciones de Hg biodisponibles (HgTD) y las asociadas al material particulado (HgTP) son también inferiores a los valores de concentración referenciados, lo cual confirma que la presencia del Hg en el Lago Cocibolca puede estar asociada al estado natural del mismo.
Las concentraciones máximas de Hg, tanto en las aguas (7,989) ng/l como en los sedimentos (0,151) µg/g peso seco, en el Lago Cocibolca fueron observadas en los primeros kilómetros desde la desembocadura del Río Tipitapa (Sitio 1) en dirección sureste sobre el transepto longitudinal de los sitios muestreados (ver Figura 1). Esto sugiere que la distribución del Hg en este lago es heterogénea, tal como lo muestran los altos valores del coeficiente de variación (CV) (ver Tabla 1) y la diferencia significativa (p<0,003, α =0,05) observada entre las concentraciones HgT en el AF y las del AS.
Respecto a las concentraciones en los sedimentos del Lago Cocibolca, estas son similares a las observadas en los sedimentos del Lago Xolotlán (0,003-0,170) µg/g peso seco, proveniente de áreas sin influencia antrópicas (MINSA et al., 2017). Estas concentraciones son hasta 56 veces inferiores al valor guía de concentración de Hg (0,170) µg/g para la protección de la vida acuática, reportados por países como Canadá (CCME, 2003) .
Los pocos cambios en los valores de las variables medidas in situ, indicados por los valores bajos de los coeficientes de variación, en el Lago Cocibolca (CV<18) (ver Tabla 1), promueven que no se observen algunas correlaciones entre estas variables y las concentraciones acuosas de Hg (ver Tabla 1). Sin embargo, estos pequeños cambios evidencian la mezcla horizontal de las aguas generada por la acción del viento. Esta mezcla es también vertical provocando que no haya diferencias significativas en los valores de esas variables (T: p>0,185, α =0,05; pH: p>0,072, α =0,05; CE: p>0,356, α =0,05; OD: p =0,051, α =0,05; ORP: p>0,715, α =0,05) observados entre el AS y el AF.
La fracción de Hg que prevalece en las AS del Lago Cocibolca es la disuelta (HgTD), la cual parece ser únicamente favorecida por los STD (r = 0,884, α=0,05) y las concentraciones de HgT (r = 0,454, α=0,05), ya que las condiciones de pH de estas aguas son ligeramente alcalinas (ver Tabla 1). El 80,0% de las concentraciones de HgTD en estas aguas son iguales o superiores a las del AF, en donde prevalecen las concentraciones de HgTP, las cuales están controladas por cambios en las concentraciones de HgT (r = 0,820, α=0,05) y la temperatura del agua (r = - 0,641, α=0,05).
Tabla 1.
Valores promedios (Prom.) de las variables medidas in situ y de las concentraciones de mercurio (Hg) en las aguas y sedimentos del Lago Cocibolca. Febrero-marzo 2022.
| Variables medidas in situ en las aguas | ||||||
|---|---|---|---|---|---|---|
| Temp. (°C) | pH | ORP (mV) |
CE (µS/cm) | OD (mg/l) |
STD (mg/l) |
|
| AS/AF | AS/AF | AS/AF | AS/AF | AS/AF | AS/AF | |
| Prom. | 26,9/26,4 | 7,7/8,0 | 157,3/159,8 | 242/239 | 9,376/8,432 | 0,117/0,116 |
| DE | 0,4/0,5 | 0,5/0,4 | 27,8/26,1 | 8/9 | 0,990/1,468 | 0,004/0,005 |
| CV | 1,6/1,8 | 6,4/5,1 | 17,7/16,4 | 3/4 | 10,5/17,4 | 3,5/4,0 |
| Concentraciones de Hg en las aguas (ng/l) y sedimentos (µg/g peso seco) | ||||||
| Agua | Sedimento | |||||
| HgTD | HgTP | HgT | HgT | |||
| AS | AF | AS | AF | AS/AF | ||
| Prom. | 0,586 | 0,490 | 1,527 | 2,735 | 2,054/3,152 | 0,093 |
| DE | 1,077 | 0,976 | 0,500 | 1,997 | 1,043/2,148 | 0,028 |
| CV | 184,0 | 199,2 | 32,7 | 73,0 | 50,8/68,1 | 29,8 |
Nota: Temp.: Temperatura; pH: Potencial de Hidrógeno; ORP: Potencial de Oxidación y Reducción; CE: Conductividad Eléctrica; OD: Oxígeno Disuelto; STD: Sólidos Totales Disueltos; AS/AF: Agua de Superficial/Agua de Fondo: HgTD: Mercurio Total Disuelto; HgTP: Mercurio Total Particulado; HgT: Mercurio Total; DE: Desviación Estándar; CV: Coeficiente de Variación.
Contrario a las concentraciones de HgTP en el AF del Lago Cocibolca, las concentraciones de esta forma de Hg en el AS están asociadas a cambios en el pH (r = 0,631, α =0,05), el ORP (r = 0,617, α =0,05) y en la CE (r = - 0,545, α =0,05). Aumentos en el pH y las condiciones oxido-reductoras se traducen en un aumento de las cantidades de Hg en su forma particulada, mientras que el aumento en la CE del agua hace que la presencia del Hg se vuelva más a la fracción disuelta, lo cual implica mayor biodisponibilidad.
Una observación importante es que las temperaturas observadas y la oxigenación de las aguas de los Grandes Lagos podrían, en gran medida estar favoreciendo la reducción del mercurio a Hg0 (Glover et al., 2010) y promoviendo su evasión de las aguas dada la poca solubilidad del Hg0. Esto limita consecuentemente la disponibilidad del mercurio para la ictiofauna, así como para el resto de los organismos acumuladores de Hg.
Al comparar las concentraciones de HgTD en el Lago Cocibolca con las del Lago Xolotlán no se observó diferencia significativa (p>0,070, α =0,05), lo cual podría sugerir que la disponibilidad del Hg en ambos ecosistemas es similar. Estas concentraciones varían respectivamente entre menor al límite de cuantificación (0,015) ng/l hasta los 4,350 ng/l y 3,510 ng/l (MINSA et al., 2017), los cuales son niveles de concentración considerados normales en los ecosistemas de agua dulce, en donde frecuentemente se han observado concentraciones inferiores a los 12,000 ng/l (Gill & Bruland, 1990).
No obstante, la biodisponibilidad y la bioacumulación del Hg depende de la cantidad de MeHg presente en las concentraciones del Hg disuelto y de las condiciones para la metilación en el cuerpo de agua, en donde, la fracción disuelta de MeHg varían entre el 1,0% y un poco más del 20,0% (Watras et al., 1998). Tomando el valor máximo de concentraciones de HgTD de las aguas del Lago Cocibolca (4,353) ng/l y asumiendo que la fracción de MeHg presente es del 20,0%, las concentraciones de MeHg en el lago serían superiores a las observadas (0,500) ng/l en cuerpos de agua con incidencia antrópica, y un orden de magnitud mayor a las concentraciones de MeHg de (0,050) ng/l típicas en lagos sin contaminación (Effler & Bloom, 1990).
La permanencia del Hg en los sedimentos de los Grandes Lagos de Nicaragua podría estar resultando en su transformación a HgCH3+ (metilmercurio). En esta forma, el Hg aumenta su disponibilidad para los organismos acuáticos, quienes lo acumulan a través de la cadena alimenticia hasta llegar al ser humano. Aun cuando, las concentraciones de Hg en el sedimento de ambos lagos sean bajas (ver Tabla 1), este compartimiento puede ser considerado una fuente importante de HgCH3+ para la cadena trófica.
Mercurio en peces de los Grandes Lagos de Nicaragua
Es probable que la baja biodisponibilidad del Hg en los Grandes Lagos de Nicaragua sea un sinónimo de una ecología sana. Sin embargo, la presencia del Hg en los peces endémicos, como los Guapotes, Mojarras y Guabinas (ver Tablas 2 y 3), podría en un futuro limitar el beneficio nutricional y económico de las comunidades pesqueras. La figura 2 muestra los niveles de mercurio en las especies estudiadas del Lago Cocibolca, aunque esos niveles son inferiores a algunas normas para el consumo de peces de agua dulce, como la de China (0,300) µg/g (PNUMA, 2005). La concentración de Hg en uno de los guapotes comprados en SJL (ver Figura 2, circulo en rojo) indica que el tamaño de esta especie podría limitar su consumo.
Cuando el Hg es transformado a HgCH3+ en los ecosistemas (Chen et al., 2019) su toxicidad es mayor a las especies de Hg inorgánico y en esta forma, el Hg es eficientemente acumulado por los organismos vivos (Morel et al., 1998) ya que es altamente soluble en lípidos (Magour et al., 1987). Desafortunadamente, por su dieta y por su alto contenido en lípidos, los peces depredadores de los Grandes Lagos como los Guapotes y Guabinas están acumulando más mercurio (ver Tablas 2 y 3).
A diferencia de la tendencia observada en las concentraciones de Hg en los pescados del Lago Xolotlán (Guapotes > Mojarras > Guabinas) (MINSA et al., 2017), la leve tendencia observada en las concentraciones de Hg con sus respectivos tamaños Guapotes > Guabinas > Mojarras (ver Tablas 2 y 3), probablemente obedezca a la cantidad reducida de pescados analizados del Lago Cocibolca, así como su rango reducido de tamaño. Otros estudios han reportado la fuerte relación que existen entre el contenido de Hg y el tamaño del pescado (Mills et al., 2019) e incluso, gracias a esta relación, el tamaño del pescado ha sido asociado al contenido de Hg y comparado con los valores guías para la protección ambiental y la salud humana (Backstrom et al., 2020).
Figura 2
Contenido de Mercurio Total (mg/kg) en pescados del Lagos Cocibolca comprados a acopios y/o pescadores de San Jorge (SJ), Rivas (Gráficos a la izquierda) y de San José del Lago (SJL), Chontales (Gráficos a la derecha). Febrero-marzo 2022.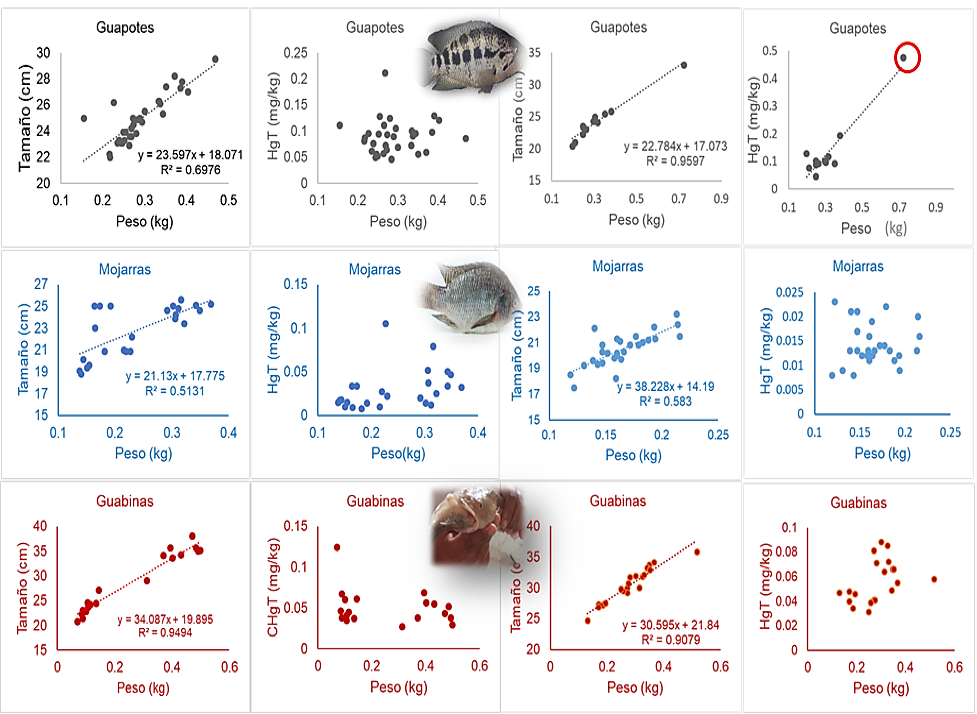
Las concentraciones de Hg en las especies estudiadas de los Grandes Lagos de Nicaragua son superiores a los 0,008 mg/kg hasta un valor de 1,020 mg/kg (ver Tabla 2), lo cual indica que estos peces han acumulado mercurio en concentraciones superiores a los valores guías para el consumo humano de peces de agua dulce (0,300) mg/kg (PNUMA, 2005). Estos resultados sugieren que el consumo de pescado para las poblaciones pesqueras debe ser limitado a las especies con niveles bajo de mercurio. Al comparar por especie las concentraciones de Hg en los pescados de ambos lagos, se encontró que existen diferencias significativas (p<0,0001, α=0,05) siendo la acumulación del Hg mayor en las especies del Lago Xolotlán (ver Tabla 3).
Análisis de Riesgo de exposición al Hg a través del consumo de pescado en comunidades pesquera de los Grandes Lagos de Nicaragua
Aunque las características de la población de las cuatro comunidades estudiadas, tales como promedios de edad y peso, así como tiempo de residencias son similares (ver Tablas 2 y 3), estas difieren en el consumo de pescado y los niveles de exposición.
Dos de las variables de mayor peso e incidencia en el análisis del riesgo son la Ingesta Diaria Personal de Hg (IDP) a través del consumo de pescado y la ingesta de pescado (IP). El promedio de IP de la población de SJL es mayor que el de la población de SJ (ver Tabla 2), consecuentemente la IDP de la población de SJL es ~60,0% mayor. Sin embargo, estas son hasta 8 veces inferiores a las IDP (ver Taba 3) de las comunidades de la cuenca del Lago Xolotlán, lo cual sugiere que en las comunidades pesqueras SFL y LBT la exposición al Hg es mayor.
Una observación importante en la caracterización de la exposición es el tiempo de exposición, ya que esta variable está asociada al riesgo (de Matos et al., 2021) y cuya inclusión en el análisis implica además la esperanza de vida de las personas expuestas (75 años). La investigación asume que el tiempo de exposición son los años que tienen los encuestados residiendo en la comunidad (ver Tablas 2 y 3), es decir, a mayor residencia más prolongada es la exposición.
La aseveración previa es justificada por el hecho de que en esta investigación ~95,0% de los encuestado afirmó consumir pescado de los Grandes Lagos, lo cual disminuye la incertidumbre en el análisis del riesgo. Adicionalmente, y a como se mencionó previamente, los promedios de residencia, edad y peso corporal de las cuatro comunidades son muy similares (ver Tabla 2 y 3), por lo cual estas variables no tendrían incidencia en el análisis comparativo del riesgo entre estas.
Las simulaciones Montecarlo compara la IDT con la IDP a través de los CA (ver Tabla 4). La IDT son valores guías para la protección de la salud humana y son utilizados por muchos países para evaluar la exposición al Hg, tomando como vía el consumo de pescado. La Tabla 4 muestra las probabilidades para los CA, es decir, cuando la p (CA =1) >0. Para la población y subpoblaciones de SJL, estas probabilidades varían desde 0,4 hasta 4,4 y son superiores a las observadas en SJ. Esto se debe a que la población de SJ tiene un promedio de IP y de IDP inferior a los de la población de SJL (ver Tabla 2).
La información resultante (ver Tabla 2) manifiesta que, un consumo de pescado del Lago Cocibolca con una concentración promedio entre 0,014 mg/kg y 0,134 mg/kg de Hg y durante un período promedio de 28 años (ver Tabla 2), la probabilidad (ver Tabla 4) de que la población encuestada de SJ evidencie efectos en su salud es muy baja (< 2,0) %, siendo nula para la subpoblación PEM y casi nula para la subpoblación PE< 18 años, cuyos valores de IDP son las más bajas.
Estas probabilidades, pudiesen aumentar con el consumo de guapotes de gran tamaño, dado que, a mayor tamaño del pescado, mayor es el contenido de mercurio (ver figura 2). Sin embargo, de acuerdo con los pescadores encuestados de SJ, ellos no consumen los pescados de gran tamaño dado que, estos son comercializados localmente para el consumo del resto de familias que no se dedican a la pesca y/o para el consumo en restaurantes. En cierta forma, esta práctica reduce el riesgo para las comunidades pesqueras.
Tabla 2.
Resumen de los datos obtenidos de las encuestas aplicadas a comunidades pesqueras de la cuenca del Lago Cocibolca y contenido de Hg en pescados del Lago Cocibolca. Febrero-marzo 2021.
| San Jorge (SJ) (n=207; F=127, M=80) |
San José del Lago (SJL) (n=135; F=74, M=61) |
|||||
|---|---|---|---|---|---|---|
| Promedio (Mín.- Máx.) | ||||||
| TResi. (años) | 28 (1-83) | 29 (2-72) | ||||
| Edad (años) | 34 (7-83) | 32 (7-72) | ||||
| Peso (kg) | 65,1 (13,2-125,6) | 63,0 (17,2-104,3) | ||||
| IP (g/día) | 116,2 (0,0-972,0) | 183,3 (7,6-907,2) | ||||
| IDP (µg/kg/día) | 0,10 (0,0-0,74) | 0,16 (0,00-0,70) | ||||
| HgT (mg/kg peso húmedo) | ||||||
| n | Promedio (Mín.- Máx.) | CV | n | Promedio (Mín.- Máx.) | CV | |
| Guapote | 12 | 0,134 (0,044-0,475) | 84,7 | 32 | 0,089 (0,046- 0,212) | 37,1 |
| Mojara | 28 | 0,014 (0,008-0,023) | 29,9 | 25 | 0,030 (0,008-0,105) | 78,1 |
| Guabina | 20 | 0,056 (0,031-0,088) | 30,7 | 39 | 0,051 (0,027-0,124) | 42,6 |
Nota: n: cantidad de encuestados, cantidad de pescado; Min.: Mínimo; Máx.: Máximo; CV: Coeficiente de Variación; F: Población Femenina; M: Población Masculina; IDP: Ingesta Diaria Personal, fue calculada en base a valores promedio de concentración del HgT en los pescados y valor promedio del % de MeHg contenido en los mismos; TResi: Tiempo de Residencia; IP: Ingesta de Pescado.
Tabla 3.
Resumen de los datos obtenidos de las encuestas aplicadas a comunidades pesqueras de la cuenca del Lago Xolotlán y contenido de Hg en pescados del Lago Xolotlán (MINSA et al., 2017).
| San Francisco Libre (SFL) (n=144; F=79, M=65) |
La Bocana de Tipitapa (LBT) (n=136; F=85, M=51) |
|||||
|---|---|---|---|---|---|---|
| Promedio (Mín.- Máx.) | ||||||
| TResi. (años) | 26 (1 – 86) | 32 (2 – 86) | ||||
| Edad (años) | 33 (7 – 93) | 38 (8 – 86) | ||||
| Peso (kg) | 64,2 (24,5 – 104,3) | 65,9 (20,4 – 127,0) | ||||
| IP (g/día) | 242,2 (7,5 – 907,2) | 109,3 (0,0 – 907,2) | ||||
| IDP (µg/kg/día) | 0,81 (0,02 – 3,17) | 0,59 (0,01 – 8,25) | ||||
| HgT (mg/kg peso húmedo) | ||||||
| n | Promedio (Mín.- Máx.) | CV | n | Promedio (Mín.- Máx.) | CV | |
| Guapote | 109 | 0,473 (0,109-1,020) | 42,2 | 37 | 0,442 (0,175- 0,897) | 41,8 |
| Mojara | 101 | 0,299 (0,013-0,620) | 45,8 | 114 | 0,209 (0,008-0,658) | 69,5 |
| Guabina | 101 | 0,248 (0,121-0,454) | 30,1 | 93 | 0,209 (0,080-0,427) | 35,5 |
Nota: n: cantidad de encuestados, cantidad de pescado; Min.: Mínimo; Máx.: Máximo; CV: Coeficiente de Variación; F: Población Femenina; M: Población Masculina; IP: Ingesta de Pescado; IDP: Ingesta Diaria Personal, fue calculada en base a valores promedio de concentración del HgT en los pescados y valor promedio del % de MeHg contenido en los mismos; TResi: Tiempo de Residencia.
Al igual que la población encuestada de SJ, la subpoblación menos expuesta en la población de SJL es PE< 18 años (ver Tabla 4). Sin embargo, al comparar la subpoblación PEM de ambas comunidades es evidente que no existe un riesgo asociado para la PEM de SJ (ver Tabla 4), ya que su IDP es la más baja. Este resultado está asociado al hecho que solo un 23,7% de la PEM (80 individuos) encuestada en SJ son pescadores, lo que se traduce a un menor consumo de pescado, contrario a los encuestados de SJL, en donde los pescadores representan el 70,0% de la PEM (61 individuos) encuestada.
Tabla 4.
Simulación Montecarlo. Valores promedio (mínimos/máximos) de Ingesta Diaria Personal (IDP), de Coeficientes de Amenaza (CA) y de las probabilidades (p) de que la exposición al Hg exceda los efectos según la Ingesta Diaria Tolerable (IDT, µg/kg/día).
Nota: TPE: Toda la población expuesta; PEF: Población expuesta femenina; PEM: Población expuesta masculina; PE>18: Población expuesta mayor a 18 años; PE<18 años: Población expuesta menor a 18 años.
Al estimar la probabilidad de que la exposición al Hg (IDP) exceda los valores de efectos (Ingesta Diaria Tolerable, IDT), observamos que, toda la población expuesta (TPE) de SJ es 2,6 veces inferior que la TPE de SJL (ver Tabla 4) y hasta 13,9 veces inferior a las de las comunidades pesqueras de la cuenca del Lago Xolotlán (ver Tabla 4).
Para las poblaciones pesqueras de la cuenca del Lago Xolotlán, existe como un máximo de probabilidades de 24,0% de que los valores de ingesta de MeHg a través del consumo de pescado superan los valores de protección a la salud humana. Este resultado está asociado al alto contenido de Hg en los pescados del Lago Xolotlán más que a la ingesta de pescado (IP) de estas poblaciones (ver Tabla 3).
Entre un 43,0% y un 47,0% de las subpoblaciones PEM, pertenecientes respectivamente a las encuestadas de SFL (61 individuos) y LBT (51 individuos), son pescadores, por lo que se esperaba que los valores de p(CA) fuesen similares. No obstante, la p(CA) de SFL es un orden de magnitud superior a la de LBT. Esto debe atribuirse a que la PEM de SFL tiene una IDP 3,4 veces mayor a la IDP de la PEM de LBT y no a otras variables como la exposición, ya que esta es longeva y similar en ambas comunidades.
Exceptuando la población <18 años de LBT, las subpoblaciones de las cuatro comunidades estudiadas con menor y mayor riesgo de exposición al Hg son respectivamente la población < 18 años y la PEF (ver Tabla 4). Sin embargo, especial atención debe prestarse a la población adulta en general de SFL, ya que las p(CA) son del 21,9%. Estos valores evidencian una exposición crónica al contenido relativamente alto de mercurio en los pescados del Lago Xolotlán, tal que el 65,0% de los pescados analizados tienen concentraciones de Hg total superiores al contenido permitido de Hg para el consumo de pescados de agua dulce (0,300) µg/g (PNUMA, 2005) .
CONCLUSIONES
Afortunadamente, las concentraciones actuales de mercurio en las aguas y en los sedimentos de los Grandes Lagos de Nicaragua son comparables a las observadas en cuerpos de agua dulce sin influencia antrópica; sin embargo, estas concentraciones resultan en una alta acumulación del mercurio en los peces.
El contenido de mercurio en los pescados de alto consumo pone en evidencia la exposición crónica al mercurio en las comunidades pesqueras de los Grandes Lagos de Nicaragua. Algunas especies han alcanzado niveles de mercurio por encima de lo permitido para la ingesta humana, lo cual se evidenciará posteriormente en el deterioro gradual de la salud de los consumidores si no se toman acciones para disminuir la exposición.
Actualmente, las probabilidades del riesgo asociada al consumo de pescado conteniendo Hg son bajas (<4,4%) para las comunidades estudiadas de la cuenca del Lago Cocibolca. Sin embargo, las probabilidades de riesgo para las comunidades pesqueras de la cuenca del Lago Xolotlán sugieren vigilar la inocuidad, en cuanto al contenido de Hg de estos recursos hidrobiológicos.
Este estudio brinda especial agradecimiento al Concejo Nacional de Universidades (CNU), el cual, a través de los Fondos Concursables de Investigación (FCI-2021), apoyó con el presupuesto total para llevar a cabo esta investigación. De igual manera, al Centro para la Investigación en Recursos Acuáticos de Nicaragua (UNAN-Managua/CIRA) y a la gestión de la Universidad Nacional Autónoma de Nicaragua (UNAN-Managua) a través de la Vicerrectoría de Gestión del Conocimiento y Vinculación Social. También a los pobladores encuestados de las comunidades pesqueras de San Francisco Libre, La Bocana de Tipitapa, San José del Lago y San Jorge.
REFERENCIAS BIBLIOGRÁFICAS
Astorqui, I. (1976). Peces de la cuenca de los grandes lagos de Nicaragua. Investigations of the Ichthyofauna of Nicaraguan Lakes. https://digitalcommons.unl.edu/ichthynicar/14
Backstrom, C. H., Buckman, K., Molden, E., & Chen, C. Y. (2020). Mercury Levels in Freshwater Fish: Estimating Concentration with Fish Length to Determine Exposures Through Fish Consumption. Archives of Environmental Contamination and Toxicology, 78(4), 604-621. https://doi.org/10.1007/s00244-020-00717-y
Bale, A. E. (2000). Modeling Aquatic Mercury Fate in Clear Lake, Calif. Journal of Environmental Engineering, 126(2), 153-163. https://doi.org/10.1061/(ASCE)0733-9372(2000)126:2(153)
Barone, G., Storelli, A., Garofalo, R., Mallamaci, R., & Storelli, M. M. (2022). Residual Levels of Mercury, Cadmium, Lead and Arsenic in Some Commercially Key Species from Italian Coasts (Adriatic Sea): Focus on Human Health. Toxics, 10(5), Article 5. https://doi.org/10.3390/toxics10050223
Boening, D. W. (2000). Ecological effects, transport, and fate of mercury: A general review. Chemosphere, 40(12), 1335-1351. https://doi.org/10.1016/S0045-6535(99)00283-0
Cavalleri, A., & Gobba, F. (1998). Reversible Color Vision Loss in Occupational Exposure to Metallic Mercury. Environmental Research, 77(2), 173-177. https://doi.org/10.1006/enrs.1997.3814
CCME. (2003). Canadian Water Quality Guidelines for the Protection of Aquatic Life—Mercury—Inorganic mercury and methylmercury. https://ccme.ca/en/res/mercury-inorganic-mercury-and-methylmercury-en-canadian-water-quality-guidelines-for-the-protection-of-aquatic-life.pdf
Chen, L., Li, F., Huang, W., Li, Z., & Chen, M. (2019). Evaluation of Mercury Transformation and Benthic Organisms Uptake in a Creek Sediment of Pearl River Estuary, China. Water, 11(6), Article 6. https://doi.org/10.3390/w11061308
Cohen, J. T., Bellinger, D. C., & Shaywitz, B. A. (2005). A Quantitative Analysis of Prenatal Methyl Mercury Exposure and Cognitive Development. American Journal of Preventive Medicine, 29(4), 353-353.e24. https://doi.org/10.1016/j.amepre.2005.06.007
Compeau, G. C., & Bartha, R. (1985). Sulfate-Reducing Bacteria: Principal Methylators of Mercury in Anoxic Estuarine Sediment. Applied and Environmental Microbiology. https://doi.org/10.1128/aem.50.2.498-502.1985
de Matos, L. S., Correa, A. S. A. S., da Silva, S. A. A., Muniz, C. C., & Ignacio, A. R. A. (2021). Mercury concentrations in fish and human health assessment in preflood phase of a hydro dam in Teles Pires River, Southern Brazilian Amazon. Elementa: Science of the Anthropocene, 9(1), 020. https://doi.org/10.1525/elementa.2021.020
Dórea, J. G., & Marques, R. C. (2016). Mercury levels and human health in the Amazon Basin. Annals of Human Biology, 43(4), 349-359. https://doi.org/10.1080/03014460.2016.1192682
Effler, S. W., & Bloom, N. S. (1990). Seasonal variability in the Mercury speciation of Onondaga Lake (New York). Water, Air, and Soil Pollution, 53(3), 251-265. https://doi.org/10.1007/BF00170741
Gill, G. A., & Bruland, K. W. (1990). Mercury speciation in surface freshwater systems in California and other areas. Environmental Science & Technology, 24(9), 1392-1400. https://doi.org/10.1021/es00079a014
Gilmour, C. C., & Henry, E. A. (1991). Mercury methylation in aquatic systems affected by acid deposition. Environmental Pollution, 71(2), 131-169. https://doi.org/10.1016/0269-7491(91)90031-Q
Glover, J. B., Domino, M. E., Altman, K. C., Dillman, J. W., Castleberry, W. S., Eidson, J. P., & Mattocks, M. (2010). Mercury in South Carolina Fishes, USA. Ecotoxicology, 19(4), 781-795. https://doi.org/10.1007/s10646-009-0455-6
Grandjean, P., Budtz-Jørgensen, E., White, R. F., Jørgensen, P. J., Weihe, P., Debes, F., & Keding, N. (1999). Methylmercury Exposure Biomarkers as Indicators of Neurotoxicity in Children Aged 7 Years. American Journal of Epidemiology, 150(3), 301-305. https://doi.org/10.1093/oxfordjournals.aje.a010002
Harada, M. (1995). Minamata Disease: Methylmercury Poisoning in Japan Caused by Environmental Pollution. Critical Reviews in Toxicology. https://doi.org/10.3109/10408449509089885
Hina, N., Riaz, R., Ali, U., Rafique, U., & Malik, R. N. (2021). A Quantitative Assessment and Biomagnification of Mercury and Its Associated Health Risks from Fish Consumption in Freshwater Lakes of Azad Kashmir, Pakistan. Biological Trace Element Research, 199(9), 3510-3526. https://doi.org/10.1007/s12011-020-02479-z
Lacayo, M., Cruz, A., Lacayo, J., & Fomsgaard, I. (1991). Mercury contamination in Lake Xolotlán (Managua). Hydrobiological Bulletin, 25(2), 173-176. https://doi.org/10.1007/BF02291251
Lawson, N. M., & Mason, R. P. (1998). Accumulation of mercury in estuarine food chains. Biogeochemistry, 40(2), 235-247. https://doi.org/10.1023/A:1005959211768
Li, Y., & Cai, Y. (2013). Progress in the study of mercury methylation and demethylation in aquatic environments. Chinese Science Bulletin, 58(2), 177-185. https://doi.org/10.1007/s11434-012-5416-4
Lindström, M. (2001). Distribution of particulate and reactive mercury in surface waters of Swedish forest lakes—An empirically based predictive model. Ecological Modelling, 136(1), 81-93. https://doi.org/10.1016/S0304-3800(00)00382-3
Magour, S., Mäser, H., & Greim, H. (1987). The Effect of Mercury Chloride and Methyl Mercury on Brain Microsomal Na + ‐K + ‐ATPase after Partial Delipidisation with Lubrol®. Pharmacology & Toxicology, 60(3), 184-186. https://doi.org/10.1111/j.1600-0773.1987.tb01730.x
Mills, N., Weber, M. J., Pierce, C. L., & Cashatt, D. (2019). Factors influencing fish mercury concentrations in Iowa rivers. Ecotoxicology, 28(2), 229-241. https://doi.org/10.1007/s10646-019-02017-1
MINSA, MARENA, CIRA/UNAN-Managua, & JICA. (2017). Repùblica de Nicaragua Proyecto para el Fortalecimiento de Capacidades en el Estudio y Análisis del Mercurio Informe Final del Proyecto. https://openjicareport.jica.go.jp/pdf/1000033590_01.pdf
Morel, F. M. M., Kraepiel, A. M. L., & Amyot, M. (1998). THE CHEMICAL CYCLE AND BIOACCUMULATION OF MERCURY. Annual Review of Ecology, Evolution, and Systematics, 29(Volume 29, 1998), 543-566. https://doi.org/10.1146/annurev.ecolsys.29.1.543
Myers, G. J., Davidson, P. W., Cox, C., Shamlaye, C., Cernichiari, E., & Clarkson, T. W. (2000). Twenty-Seven Years Studying the Human Neurotoxicity of Methylmercury Exposure. Environmental Research, 83(3), 275-285. https://doi.org/10.1006/enrs.2000.4065
Picado, F., Mendoza, A., Cuadra, S., Barmen, G., Jakobsson, K., & Bengtsson, G. (2010). Ecological, Groundwater, and Human Health Risk Assessment in a Mining Region of Nicaragua. Risk Analysis, 30(6), 916-933. https://doi.org/10.1111/j.1539-6924.2010.01387.x
PNUMA. (2005). EVALUACIÓN MUNDIAL SOBRE EL MERCURIO. https://saludsindanio.org/sites/default/files/documents-files/1401/Evaluacion_Mundial_Mercurio.pdf
Ravichandran, M. (2004). Interactions between mercury and dissolved organic matter––a review. Chemosphere, 55(3), 319-331. https://doi.org/10.1016/j.chemosphere.2003.11.011
Slotton, D., Ayers, S., Suchanek, T., Weyand, R., & Liston, A. (2004). Mercury Bioaccumulation and Trophic Transfer in the Cache Creek Watershed, California, in Relation to Diverse Aqueous Mercury Exposure Conditions.
Watras, C. J., Back, R. C., Halvorsen, S., Hudson, R. J. M., Morrison, K. A., & Wente, S. P. (1998). Bioaccumulation of mercury in pelagic freshwater food webs. Science of The Total Environment, 219(2), 183-208. https://doi.org/10.1016/S0048-9697(98)00228-9
Watras, C. J., & Huckabee, J. W. (1994). Mercury Pollution Integration and Synthesis. CRC Press.
Watras, C. J., Morrison, K. A., Hudson, R. J. M., Frost, T. M., & Kratz, T. K. (2000). Decreasing Mercury in Northern Wisconsin: Temporal Patterns in Bulk Precipitation and a Precipitation-Dominated Lake. Environmental Science & Technology, 34(19), 4051-4057. https://doi.org/10.1021/es000991g
Wright, D. A., & Welbourn, P. (Eds.). (2002). Metals and other inorganic chemicals. En Environmental Toxicology (pp. 249-348). Cambridge University Press. https://doi.org/10.1017/CBO9780511805998.008
Yorifuji, T., Tsuda, T., Inoue, S., Takao, S., Harada*, M., & Kawachi, I. (2013). Critical Appraisal of the 1977 Diagnostic Criteria for Minamata Disease. Archives of Environmental & Occupational Health, 68(1), 22-29. https://doi.org/10.1080/19338244.2011.627894
© 2024 Revista Científica Estelí.
![]() Este trabajo está licenciado bajo una Licencia Internacional Creative Commons 4.0 Atribución-NoComercial-CompartirIgual.
Este trabajo está licenciado bajo una Licencia Internacional Creative Commons 4.0 Atribución-NoComercial-CompartirIgual.
