Microplásticos en un ecosistema lagunar del trópico húmedo nicaragüense y su incidencia en poblaciones de Crassostrea rhizophorae
Microplastics in a lagoon ecosystem of the Nicaraguan humid tropics and their impact on Crassostrea rhizophorae populations
Billy Francis Ebanks Mongalo
Bluefields Indian & Caribbean University - BICU, Nicaragua.
https://orcid.org/0000-0001-5822-9308
billy.ebanks@bicu.edu.ni
Enoc Geremías Rivas Suazo
Bluefields Indian & Caribbean University - BICU, Nicaragua.
https://orcid.org/0000-0002-7715-9322
enoc.rivas@do.bicu.edu.ni
Eduardo Alexander Siu Estrada
Bluefields Indian & Caribbean University - BICU, Nicaragua
https://orcid.org/0000-0002-5104-747X
eduardo.siu@bicu.edu.ni
Juan Asdrúbal Flores-Pacheco
Bluefields Indian & Caribbean University - BICU, Nicaragua.
https://orcid.org/0000-0001-6553-7202
asdrubal.flores@do.bicu.edu.ni
RECIBIDO
10/01/2024
ACEPTADO
08/07/2024
RESUMEN
El objetivo del estudio fue identificar microplásticos en agua, arena, sedimento y en la biota (Crassostrea rhizophorae) en la barra de Houn Sond, al sur de la laguna de Bluefields, Nicaragua. Dado que no existen estudios previos que permitan referenciar las afectaciones, este análisis proporciona datos fundamentales. Las muestras de agua se obtuvieron utilizando una red Bongo de 65 µm a una velocidad de 3 km/h, con tres réplicas; las de arena mediante un transecto sobre la línea costera de pleamar; el sedimento con una draga Van Veen de 6” x 6” pulgadas; y las de ostiones en bancos identificados al azar. La identificación de microplásticos se realizó mediante saturación de agua con cloruro de sodio y observación estereoscópica, mientras que las muestras de ostiones se analizaron por digestión química con H2O2 al 30%. De 1,296.073 m³ de agua filtrada, se identificaron 0.475 g de microplásticos y una partícula de goma de 0.022 g, siendo el color más abundante el blanco hueso con 0.329 g. En la arena se encontraron 23.282 g de microplásticos, con una mayor presencia del color blanco hueso (13.473 g). No se observaron microplásticos en el sedimento ni en las muestras de ostiones.
PALABRAS CLAVES
Ecosistema lagunar; impacto en la biota; microplásticos; sedimento
ABSTRACT
The objective of this study was to identify microplastics in water, sand, sediment and biota (Crassostrea rhizophorae) in the Houn Sond bar, south of Bluefields lagoon, Nicaragua. Since there are no previous studies to reference the effects, this analysis provides fundamental data. Water samples were obtained using a 65 µm Bongo net at a speed of 3 km/h, with three replicates; sand samples were obtained using a transect along the high tide coastline; sediment samples were obtained using a 6“ x 6” inch Van Veen dredge; and oyster samples were obtained from randomly identified banks. Microplastic identification was performed by water saturation with sodium chloride and stereoscopic observation, while oyster samples were analyzed by chemical digestion with 30% H2O2. Out of 1,296.073 m³ of filtered water, 0.475 g of microplastics and a 0.022 g rubber particle were identified, the most abundant color being off-white with 0.329 g. In the sand, 23.282 g of microplastics were found, with a higher presence of off-white (13.473 g). No microplastics were observed in the sediment or oyster samples.
KEYWORDS
Lagoon ecosystem; impact on biota; microplastics; sediment.
INTRODUCCIÓN
Los microplásticos, como se ha denominado a las partículas de plástico con tamaño menor a 5 milímetros, se han encontrado distribuidos ampliamente en todo el planeta, en los océanos, costas, lagos y ríos, incluso de los sitios más remotos. Estos microplásticos provienen fundamentalmente de procesos de foto degradación y fragmentación de plásticos de mayor tamaño, pero también de productos cosméticos como exfoliantes, pasta dentífrica y productos de limpieza que contienen microesferas plásticas, así como de fibras sintéticas provenientes de la ropa (Herrera, et al., 2017).
Además de contaminar, los plásticos no se reciclan adecuadamente, favoreciendo la degradación de los mismos y su paso a los seres vivos, especialmente a los de ecosistemas acuáticos, encontrándose en la mayoría de ellos partículas plásticas de diferentes tamaños, que pueden pasar al ser humano a través de su ingesta (Aranda et al., 2022). La ciudad de Bluefields al igual que otras ciudades del mundo está rodeada de plástico, se puede ver en todos sus alrededores botellas plásticas de diferentes marcas, formas y colores tiradas por toda la vía pública. En los hogares se puede encontrar una gran cantidad de artículos plásticos que al dar su vida útil son desechados y en su gran mayoría llegan al igual que las botellas plásticas a la laguna por los procesos de escorrentías de los causes naturales o artificiales (Suárez Miranda et al., 2022).
Antes de crearse los polímeros, la madre naturaleza era la única y exclusiva fuente de materiales con que el hombre contaba para la realización de sus herramientas, útiles y objetos de uso cotidiano. Las propiedades que ofrecían las piedras, las maderas o los metales no satisfacían todas las demandas existentes. Así que, el hombre en su innato afán de investigación y búsqueda comenzó a aplicar sustancias que suplieran estas carencias. Se manipularon polímeros naturales como el ámbar, el asta natural, la goma laca y la gutapercha, que son los precursores de los polímeros actuales (García, 2008).
El plástico en la sociedad contemporánea ha llegado para quedarse, debido a que nos permite tener artículos a más bajo precio que otros materiales que cumplen las mismas funciones que se les da, pero con una vida útil menor y por su bajo costo son más desechable (Muriel, 2020). Actualmente es difícil encontrar hogares en lo más profundo de las comunidades donde no exista el uso del plástico, ya que este viene acompañado del valor agregado que se le da a la materia prima (emplasticado para una mejor presentación).
Entre los organismos vulnerables a la ingestión se encuentran los filtradores tanto pelágicos como demersales, suspensivoros y depositivoros bentónicos, macroinvertebrados, peces, reptiles y mamíferos, los cuales los ingieren de forma directa o a través de la ingestión de otros organismos (Guzzetti et al., 2018; Reed et al., 2018, citado por Vásquez et al.2021). Por todo lo antes mencionado, se ha escogido describir la presencia de microplásticos en tres de sus componentes importante de la laguna: la columna superficial, debido a que es el área donde se da la producción primaria; la biota (ostiones de mangles, Crassostrea rhizophorae) como organismos filtradores; y el sedimento, el cual indicará como se almacenan los microplásticos en el fondo del ecosistema acuático.
En la actualidad no existen estudios de microplástico en el ecosistema de la laguna de Bluefields (agua, biota, arena y sedimento), que permita tener una referencia de las afectaciones de estas partículas, las cuales en la actualidad son un problema emergente y que en estudios de diferentes partes del mundo han reportado la presencia de microplástico a todos los niveles de los ecosistemas terrestres y acuático, provocando también afectación a la biota acuática.
El objetivo de este artículo fue identificar la presencia de microplásticos en la columna plantónica del agua en la parte sur de la laguna y su incidencia en poblaciones de Crassostrea rhizophorae debido a que es un organismo filtrador y puede retener alta concentración de partículas de plásticos. Además, es importante en la dieta de los ciudadanos que habitan alrededor de la laguna. De la misma manera, se realizaron estudios en sedimento el cual brindo un diagnóstico del comportamiento de estas partículas en el fondo de la laguna.
Los resultados de este estudio darán información científica sobre la presencia de microplásticos a nivel del ecosistema lagunar. Por otro lado, los resultados podrán servirles a instituciones regionales, nacionales entre otras que estén trabajando en temas de salud ambiental u otras áreas afines y a los consumidores de productos acuáticos.
El estudio beneficia directamente a los consumidores de productos acuáticos (escama, crustáceos y moluscos) por lo que tendrán información directa de la zona donde se extraen los productos de consumo. Como beneficiario secundario está la comunidad científica debido a que la información que se generó es carácter público y disponible para usos académicos.
MATERIALES Y MÉTODOS
Área de localización del estudio
Este estudio se realizó en el costado sur de la laguna de Bluefields, en la bocana de la barra de Houn Sond (figura 1). La laguna de Bluefields es el receptor natural de los escurrimientos de agua de lluvia de las cuencas de los ríos Escondido (61) y Kukra River (63). En la cuenca de río Escondido se han desarrollado actividades agropecuarias intensivas, con el cultivo del banano (Musa sp.) desde la década de 1960; con el cultivo de la caña de azúcar (Zacharum officinarum) durante las décadas de 1970 y 1980, y actualmente, con el cultivo de la palma africana (Elais guiniensis) (Ebanks Mongalo et al., 2015).
Este estudio es de tipo descriptivo por lo que se pretende caracterizar la presencia de microplásticos en el agua de la laguna, sedimento, arena y biota (ostiones de mangles). Es de corte trasversal ya que solo se realizó un muestreo, en la época lluviosa (julio) de 2022 (INETER, 2015 & Flores-Pacheco et al., 2019).
Figura 1. Mapa del área y puntos de muestreos de microplásticos.
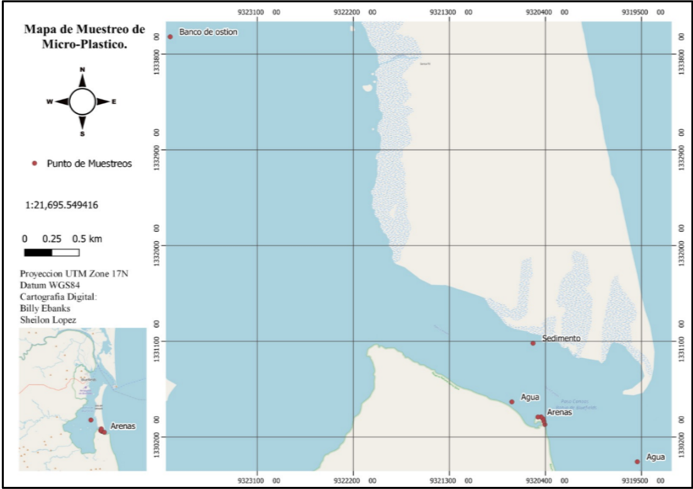
Zonificación de muestreo
El tipo de muestreo es probabilístico al azar, debido a que se busca obtener información de los microplásticos en los puntos de mayor salida de la laguna con arrastre a una velocidad constante de 3 km/h y abertura de agua constante (Gutierrez Rojas, 2016). La muestra de arena se tomó por transepto sobre la línea costera de la pea mar. Se obtuvo cinco muestras, una por cada litro y con un peso de 2 kg. La toma de sedimento se realizó de manera azarosa lanzando una draga Van Veen de 6” x 6” pulgadas (15.54 cm2). Los ostiones fueron obtenidos de los bancos encontrados entre la isla de Rama Cay en las siguientes coordenadas (N 11.89678 – W 83.75816).
Etapas de investigación
Etapa 1: Muestreo y recolección de datos función del medio
Agua: Esta metodología fue modificada a partir del Instituto de Investigaciones Marinas y Costeras (2017). Las muestras se tomaron con una red bongo de muestreo de neuston o de plancton con luz de malla entre 65 µm, ajustada con boyas laterales para su flotabilidad. A la red se le adapta un flujómetro en la apertura de la boca de tal forma que quede completamente sumergido durante el arrastre. La red se sujetó a la lancha mediante una cuerda ubicada en la parte lateral de la embarcación con el fin de evitar posibles alteraciones de los resultados.
Una vez puesta la red en el agua, se ajustó a una distancia de entre 5 - 7 metros de la panga y se inicia el recorrido en el primer transecto a una velocidad constante de 3 km/h, durante 15 minutos. En cada transecto se tomaron datos de presencia de macroplásticos (productos plásticos mayores a 5 mm) en el área de muestreo, registros fotográficos y la velocidad de la embarcación (m/s). Al finalizar el recorrido se tomaron los datos finales del flujómetro, hora, coordenadas geográficas y el tiempo en el que la red permaneció en el agua con la ayuda de un cronómetro (Ebanks Mongalo et al., 2024).
En cada transecto se sacó la red del agua, para ser lavada con agua destilada filtrada desde la boca o apertura de ésta hasta el vaso colector; con el fin de que toda la muestra quede almacenada en éste. Se transfirieron las muestras del colector de un frasco lavado con agua destilada a un recipiente para muestras de 500 mL rotulado con el nombre del sitio, tipo de muestra, fecha y número de transecto.
Finalmente, la muestra se fija con hipoclorito al 10% para su posterior análisis en laboratorio. En cada transecto se repite el proceso. Se calculó el volumen del agua filtrada por la red a partir de los datos del tiempo de recorrido, diámetro de la red mediante la ecuación 1:
VFiltrado = π x r2 x Distancia recorria Ecuación 1
Donde:
VFiltrado = Volumen filtrado (m3)
r2 = radio de la red al cuadrado
Distancia recorrida (m)
Arena: Esta metodología fue modificada de Cabrera (2018) para darle salida al objetivo de investigación. Se midieron 100 metro lineales sobre la línea costera precisamente sobre la pleamar, dividiéndose en cinco transeptos 25 metros entre cada uno de ellos. Se georreferenció cada uno de los puntos, los cuales se ubicaron en un mapa de identificación de microplásticos.
Para la toma de muestra en cada punto, se colocó un marco de madera de 0.5 m2. La muestra de arena se tomó con una cuchara metálica de 7.7 x 20.6 cm, a una profundidad aproximada de 1 cm. Las muestras se guardaron en bolsas plásticas de 18 kilogramos y se trasladaron al Centro de Investigaciones Acuáticas de BICU (CIAB).
Sedimento: Este se realizó modificaciones a la metodología empleada por Mazarlego (2021). La muestra de sedimento se tomó de forma directa, lanzando una draga con capacidad de captura de 1 kg de sedimento hacia el fondo de la laguna a una profundidad aproximada de 2 metros. En el laboratorio los sedimentos se secaron a una temperatura de 60 °C. Posteriormente, se pesaron para identificar la relación de peso seco. Las muestras secas se pulverizaron con un mortero de porcelana.
Se pesaron 50 gr de cada muestra en una balanza analítica a los cuales se le añadieron 200 ml de la disolución saturada de NaCl en agitación durante 2 minuto, dejándola reposar durante 10 minutos para permitir que los microplásticos quedaran flotando en la superficie de la disolución y que la arena se depositara en el fondo.
El sobrante se separó con una pipeta de vidrio. El material filtrado se conserva en una placa de Petri para su recuento. Este proceso se repete dos veces por muestra con el fin de garantizar la completa extracción de estos. Las partículas de microplásticos se guardaron en frascos de vidrios. El recuento se realizó con el mismo método empleado en la arena.
Microplásticos en ostiones (Crassostrea rhizophorae): Para cuantificar la presencia de microplásticos en Crassostrea rhizophorae se utilizó la técnica descrita por Mathalon y Hill (2014) citado por Rodríguez Perera (2019) basada en separar el tejido blando de la concha colocando 10 gramos de éste en un recipiente. Se agregaron 150 - 200 ml de peróxido de hidrogeno (H2O2) al 30% a cada muestra. Seguidamente se colocaron las muestras en estufa con agitador a 65 °C hasta que el H2O2 se evaporó.
Para preparar la solución salina concentrada, se agregaron 250 gramos de NaCl por litro de agua, más 100 ml de solución salina por muestra. Todo se agitó durante 1 a 2 minutos para optimizar el proceso. Luego, se dejó reposar de 3 a 6 minutos antes de pipetear el sobrenadante y filtrarlo. El filtrado fue observado en lupa estereoscópica (Rodríguez Perera, 2019).
Para este estudio se recolectaron 300 ejemplares de ostiones de los bancos cercanos a la Isla de Rama Cay ubicada en la zona sureste de la laguna de Bluefields. De cada muestra se extrajeron 100 gramos de tejido blando que se colocaron en un vaso de Bohemia para la digestión química de estos con el uso 150 mL de una solución de peróxido de hidrógeno (H2O2) a una concentración de 30% (100 volúmenes). Las muestras con H2O2 se colocaron en una plancha calefactora a 120° C con agitador a 100 rpm para llegar en la mezcla 65 °C constantes hasta que los tejidos fueron digeridos y el líquido se evaporó.
Luego de retirar las muestras de la plancha se agregaron 100 ml de la solución salina concentrada (250 g/l) para separar los microplásticos por flotación, agitando vigorosamente la muestra durante aproximadamente por 2 minutos y dejándola reposar de 5 a 10 minutos. La separación física se realizó mediante la técnica de flotación filtrando las muestras con un sistema de vacío Sartorius con filtro de 8 micrómetros de tamaño de poro. Luego se observó en el estereoscopio (X40) repitiendo por cada filtro para la determinación de la existencia de microplásticos en las muestras.
Con base a lo expuesto por Li et al. (2015) se realizó el conteo de las partículas plásticas presentes diferenciándolas en fibras, fragmentos, y pellets según la clasificación de Jabeen (2017).
En los casos cuando la muestra a analizar presentó abundante materia orgánica se le adicionaron 10 - 30 mL de hipoclorito de sodio al 10% dejándola reposar entre 24 a 48 horas, con el fin de eliminarla y así reducir la interferencia en la identificación de los microplásticos (Flores-Pacheco et al., 2013). El total del volumen (m3) se filtró en un tamiz metálico para ser transferido a una caja Petri donde ser observada en un estereoscopio (FOCUS con 10 X de aumento) con el fin de separar las muestras de microplásticos. Se determinaron las variables de forma, color, cantidad y tamaño de cada pieza.
Las formas son registradas según las categorías propuestas por Kovac et al. (2016) citado por Instituto de Investigaciones Marinas y Costeras (2017): fragmento, películas transparentes (films), pellets, gránulos, filamentos y espuma (foamy, esponja plástica o icopor). Se calculó la concentración por transecto muestreado, expresándose en microplásticos/m3. Para controlar la posible contaminación con fibras durante el análisis de laboratorio, se utilizan recipientes testigos con agua destilada filtrada que permanecen junto a la muestra durante el procedimiento, las cuales se revisan al terminar cada observación.
Diagrama de flujo para el análisis de microplásticos en aguas superficiales en laboratorio.
- Trasferir el contenido a una caja Petri y observar al estereoscopio.
- Separar muestras por tamaño, tipo y color registrando el número de artículos/m3 según Kovac et al. (2016).
Etapa 2: Separación de microplásticos
Las muestras se secaron en un horno (J.P. SELECTA serial 0419489), a 60 ºC durante 48 horas. Transcurrido este tiempo, se dejaron enfriar a temperatura ambiente. Posteriormente se prepararon 2 litros de disolución saturada pesando 359 g de sal (NaCl) en una balanza analítica (KERN ALJ, serie WL 101412) que serían disueltos en agua destilada. Se empleó un agitador magnético, para la homogenización del medio, posteriormente se eliminaron impurezas de la sal en la disolución con un filtro de 0.45 µm de diámetro de poro.
Se pesaron 50 gr de cada muestra recolectada en una balanza, a ésta se le añadieron 200 ml de la disolución saturada de NaCl homogenizada con un agitador magnético a 200 RPM, durante 2 minutos. Posteriormente, se dejaron reposar las muestras durante 10 minutos para permitir que los microplásticos quedaran flotando en la superficie de la disolución una vez que la arena se decantará en el fondo del frasco. Los microplásticos se retiraron con una pipeta de vidrio para ser colocado en una placa de Petri para su recuento. Este proceso se repitió dos veces por muestra con el fin de garantizar la extracción completa de las partículas en suspensión.
Etapa 3: Recuento y clasificación de microplásticos
Para el recuento de los microplásticos se utilizó un estereoscopio (FOCUS) más una cámara para fotografiar los microplásticos. Todas aquellas partículas y fibras que se parecían a microplásticos se les tomó fotografía separadas con ayuda de pinzas de disección y se conservaron en frascos de vidrios. Para clasificar los tipos microplásticos (MPs) identificado en este estudio se adoptaron cinco categorías descritas por Rezania et al., (2018):
- Pellet: piezas de plástico aproximadamente cilíndricas, discoides, ovoides o esferoides Con superficie lisa, (es decir, una morfología homogénea).
- Fragmento: pieza de plástico de forma irregular, de bordes afilados, angulares y subangulares.
- Fibra: hebra o filamento de plástico con una alta relación longitud/radio, de espesor aproximadamente igual en toda su longitud y con una flexión generalmente tridimensional.
- Film: pieza de plástico como una lámina delgada, plana y maleable.
- Foam (styrofoam): son livianos, presentan aspecto como de esponja, son compresibles y suelen ser de color blanco.
La clasificación por colores se realizó en base a lo indicado por Frias, Pagter, Nash, & O'Connor (2018), con algunas modificaciones debido a la cantidad de microplásticos encontrados en cada color.
Figura 2. Paleta de colores para la clasificación de microplásticos

Etapa 4. Análisis de datos
Los datos recopilados en las etapas previamente descritas fueron ingresados en una base de datos de Microsoft® Excel, donde se ordenaron según sitios y medios de muestreo. Posterior a la limpieza y depuración de registros, los datos se trasladaron al programa SPPS versión 27 (IBM, 2022). En este programa, se realizaron análisis descriptivos e inferenciales empleando pruebas paramétricas de Chi-cuadrado y análisis de varianza (ANOVA) para la comparación de las variables de interés (Pilco Sucasaire & Ticona Vilcapaza, 2023).
RESULTADOS Y DISCUSIÓN
En el área de estudio se observó la presencia de basura marina de diferentes tipos desde botellas plásticas, restos de galones, trozos de sillas y otros restos de plásticos sólidos (figura 3). También se encontraron diferentes tipos de calzado, arrastrados hasta este sitio por las corrientes de marea que entran y salen con los respectivos cambios de mareas. En los estudios de presencia y tipo de microplásticos realizados a los diferentes ecosistemas de la parte sur de la laguna de Bluefields (barra de Houn Sond) se obtuvieron los siguientes resultados.
Figura 3. Basura marina encontrada en el área de muestreo de microplásticos en arena

Agua
Volumen Filtrado = π x r2 x Distancia recorria
Velocidad = 3 Km/h = 0.05 Km/min
Distancia recorrida = 0.0 5 Km/min x 15 min = 0.75 Km = 750 m
Pi (π) = 3.1416
Radio de la red bongo = Diámetro/2 (D/2) = 36.62 cm = 18.31 cm = 0.1831 m
V. filtrado = (π) = 3.1416 x recorrido red bongo = 0.1831 m2 x
Distancia recorrida = 750 m
V. filtrado = 432.024m3 por arrastre, en este estudio se realizaron 3 por lo que el total de agua filtrada fue de 1,296.073m3 de agua de la laguna.
Los hallazgos en gramos, encontrados en agua filtrada de la laguna y posteriormente estudiadas en el laboratorio del CIAB con el método de saturación con cloruro de sodio (NaCl), se reflejan a continuación en la figura 4.
Figura 4. Identificación de microplásticos por colores en agua filtrada de la laguna de Bluefields.
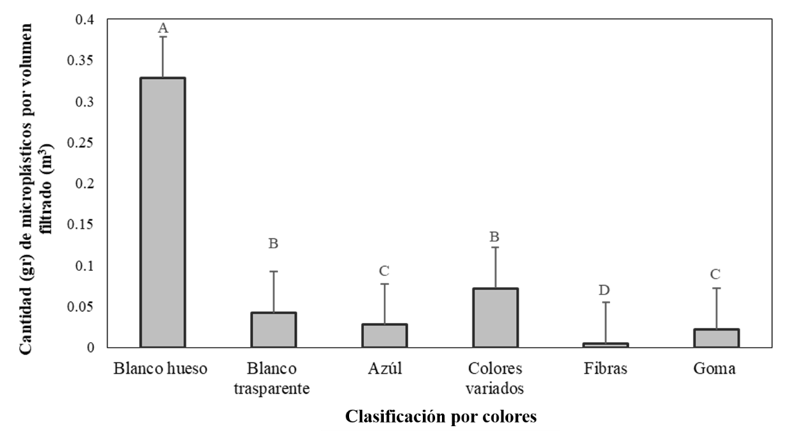
En la Figura 4, se observa que la mayor cantidad de microplásticos encontrada en un volumen de 1,296.073 m³ de agua filtrada de la laguna corresponde a partículas de varios colores. Entre ellas, se destacan los microplásticos de color blanco hueso (0.329 g) y blanco transparente (0.042 g), seguidos por microplásticos de color azul (0.028 g) y una suma de colores variados en pequeñas cantidades (0.072 g), que fueron agrupadas en un solo conjunto. El análisis estadístico (X²=65.24; gl=2; P<0.000) indica una distribución significativa de los colores de los microplásticos presentes.
La predominancia de microplásticos de color blanco, tanto en su variante hueso como transparente, es particularmente significativa. Esta tendencia puede estar relacionada con varias fuentes y procesos ambientales. Los microplásticos blancos son comunes en productos de consumo diario, como envases plásticos, bolsas, y otros materiales que se degradan y fragmentan en el ambiente (Ebanks Mongalo et al., 2024). Además, el color blanco puede provenir de la degradación de plásticos de mayor tamaño que inicialmente eran de otros colores, pero han perdido sus pigmentos debido a la exposición a la intemperie y la radiación UV.
También deben analizarse que los procesos de degradación de los plásticos transparentes y blancos suelen fragmentarse más fácilmente y pueden ser menos resistentes a la degradación UV, lo que resulta en una mayor presencia de microplásticos de estos colores en ambientes acuáticos. Así mismo, los microplásticos blancos pueden ser más fácilmente detectados durante los procesos de muestreo y análisis, debido a su alta visibilidad en comparación con microplásticos de colores más oscuros o translúcidos.
La predominancia de microplásticos blancos ha sido reportada en otros estudios a nivel global. Por ejemplo, investigaciones realizadas en ambientes marinos y de agua dulce han encontrado una alta presencia de microplásticos de color claro, lo cual coincide con los resultados obtenidos en este estudio de la laguna. Estudios como el de Thompson et al. (2004) y Gasperi et al. (2018), también reportan una alta prevalencia de microplásticos de color blanco y transparente, sugiriendo una tendencia común en la contaminación por microplásticos en diversos cuerpos de agua.
La presencia significativa de microplásticos de color blanco en el agua de la laguna no solo refleja patrones de consumo y degradación de plásticos, sino que también es consistente con hallazgos en otros estudios. Esto subraya la necesidad de estrategias de gestión de residuos más efectivas y políticas de reducción de plásticos para mitigar la contaminación por microplásticos, especialmente aquellos de color blanco que parecen prevalecer en el ambiente.
En el mismo muestreo se logró identificar algunas fibras (0.004 gr), que representa la diversidad de microplásticos presentes en los ecosistemas intervenidos. Sin embargo, este resultado no debe obviarse al representar un riesgo para la salud ecosistémica al ser cantidades elevadas en relación con la poca agua filtrada; estas pueden llegar al mar o la laguna provenientes de la degradación de los aperos de pesca abandonados por cumplir con su ciclo de utilidad. Adicionalmente, se identificó la presencia de trozos de goma formando conglomerados en suspensión en el agua en donde se identificaron parte de las micropartículas (figura 6).
Figura 5. Diferentes tipos y colores de microplásticos en agua de la laguna de Bluefields

Los resultados de este estudio coinciden con los publicados de Vidal, Molina & Duque (2021) en los que indican que los mayores hallazgos de microplásticos fueron los fragmentos que correspondieron al (63.5%) y en menos cantidad las fibras con el (36.1%) y finalmente los pellets con (0.4%) con la diferencia que en este estudio se logró identificar una partícula de goma con peso de (0.0217 gr).
Arena
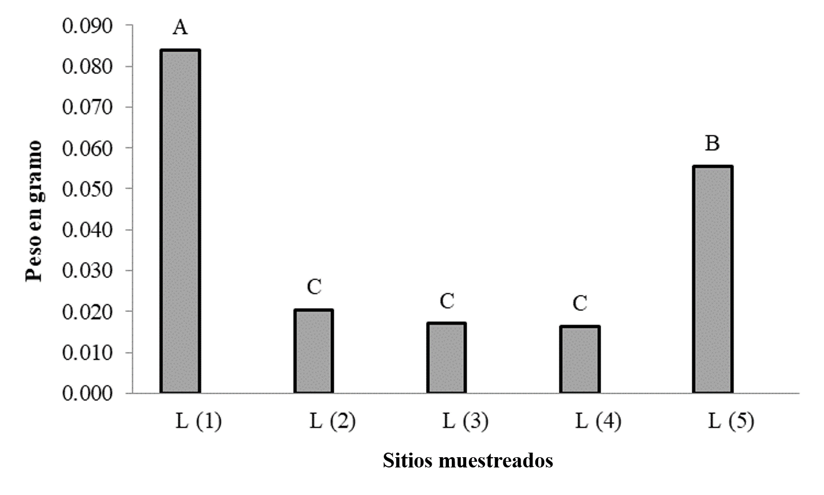
La identificación y tipo de microplásticos en arena de la playa en la parte sur de la laguna de Bluefields (barra de Houn Sond) por medio del método de transectos de 1 m2 e identificación física, se obtuvieron los siguientes resultados representados en la siguiente tabla 2 donde se encuentran representados las partículas de microplásticos identificadas durante el estudio de la arena de la playa y posteriormente analizadas en el CIAB-BICU. Los mismos fueron identificados por su color, tipo y área de las parcelas. De forma general se determinó por el método de saturación, separación y posterior observación posteriormente con estereoscopio, que los fragmentes de color blanco hueso (F=3.20; gl=4; P-valor<0.000) son los que se encontraron en mayor cantidad (58%), este resultado se debe a la degradación de objetos de plásticos de mayor tamaño tales como valdes, restos de galones, cillas y otros utensilios de uso cotidiano, arrastrados a la zona por el oleaje.
Tabla 2: Microplásticos en arena (peso en gramos por color). Letras distintas indican diferencia estadística al 95% de confiabilidad.
| Color | L (1) | L (2) | L (3) | L (4) | L (5) |
|---|---|---|---|---|---|
| Blanco hueso | 1.905 a | 4.968 a | 2.206 a | 1.981 a | 2.413 a |
| Blanco trasparente | 0.767 b | 1.051 b | 1.353 b | 0.951 b | 1.109 b |
| Azul | 0.257 c | 0.208 c | 0.300 c | 0.147 d | 0.128 d |
| Verde - celeste | 0.264 c | 0.386 c | 0.262 c | 0.265 d | 0.169 d |
| Colorees variados | 0.112 c | 0.588 c | 0.551 c | 0.568 c | 0.370 c |
El blanco trasparente (23%), se encontró de segundo en cantidades (F=0.00; gl=4; P-valor<0.035) identificadas en la zona. La presencia de estos fragmentos se puede deber a la fotofragmentación de residuos de botellas de agua que llegan a las playas provenientes de la ciudad y otros asentamientos en las comunidades los cuales son arrastrado por la acción de los ríos que desembocan en la laguna, también por la acción de las olas y las mareas en la zona de estudios (Matus-Román et al., 2020).
Los colores identificados en menor cantidad (Figura 6) fueron los microplásticos de colores variados (9%), verde-celeste (6%) y, por último, partículas de color azul (4%). Estos resultados contrastan significativamente con los obtenidos por Zarate e Iannacone (2021), quienes reportaron que la mayor cantidad de microplásticos hallados en su estudio eran de color azul y amarillo, con formas alargadas e irregulares, predominantemente provenientes de ropa sintética y alfombras. Además, en su investigación se identificaron microplásticos de color azul oscuro, rojo, blanco y azul en formas alargadas, ovoides y redondeadas, originados principalmente de textiles sintéticos y tubos.
Este contraste en los resultados puede deberse a diversas variables ambientales y antropogénicas que influyen en la distribución y características de los microplásticos. En el presente estudio, la menor proporción de microplásticos de color azul podría estar relacionada con diferencias en las fuentes de contaminación local, las condiciones hidrodinámicas de la laguna y los métodos de muestreo utilizados. Por otro lado, la predominancia de microplásticos de colores variados y verde-celeste sugiere una fuente diversa de contaminación, posiblemente vinculada a residuos plásticos generales y fragmentos de productos consumibles.
Estos hallazgos subrayan la importancia de realizar estudios comparativos en diferentes entornos y con metodologías consistentes para comprender mejor las dinámicas de la contaminación por microplásticos. Además, destacan la necesidad de estrategias específicas para gestionar y mitigar las fuentes de microplásticos en diferentes regiones.
Figura 6. Diferentes tipos y colores de microplásticos en arena

Durante este estudio se identificó la presencia de poroplas en el área, se determinó que en la L1 (0.0840gr) y L5 (0.0555 gr) son las que presenta mayor cantidad de partículas de poroplas (F=0.86; gl=4; P-valor>1.00), mientras la que presenta menor cantidad es la L3 (0.0170 gr).
Figura 7. Identificación de poroplas en arena
La presencia de microplásticos en las playas de la región está principalmente asociada a la degradación de utensilios de pesca, especialmente las boyas utilizadas como señalizadores para la ubicación de trasmayos, nasas y rutas acuáticas, con el fin de evitar el encallamiento de embarcaciones livianas (Suárez Miranda et al., 2022). Además, estos microplásticos provienen de la degradación de termos utilizados para mantener la frescura de las capturas durante largas jornadas de pesca.
Asimismo, los microplásticos pueden ser transportados por las corrientes de diversos ríos que desembocan en la laguna de Bluefields, arrastrando consigo residuos plásticos desde distintas comunidades de la región (Ebanks Mongalo et al., 2015). Estos ríos actúan como vectores, acumulando y redistribuyendo microplásticos de diversas fuentes terrestres y acuáticas.
Este fenómeno refleja la complejidad de las fuentes de contaminación por microplásticos, donde no solo las actividades pesqueras contribuyen, sino también la gestión inadecuada de residuos plásticos en comunidades a lo largo de las cuencas fluviales. Los estudios han demostrado que los microplásticos pueden tener orígenes diversos, incluidos productos de consumo diario, envases, textiles y otros materiales plásticos que se fragmentan y dispersan a través de los ecosistemas acuáticos (Zarate & Iannacone, 2021).
La identificación y cuantificación de estos microplásticos es crucial para diseñar estrategias efectivas de mitigación y gestión de residuos. La cooperación interinstitucional y el desarrollo de políticas ambientales robustas son fundamentales para reducir la carga de microplásticos en los ecosistemas marinos y costeros, asegurando la salud ambiental y la sostenibilidad de las actividades económicas dependientes del agua.
Sedimento y Crassostrea Rhizophorae
En los análisis realizados sobre la presencia de microplásticos, no se observaron partículas de estos en la materia blanda de Crassostrea Rhizophorae. Esta ausencia puede atribuirse a varias razones, entre las que destacan la velocidad de la corriente y la salinidad del agua. La velocidad de la corriente puede influir en la distribución y asentamiento de partículas en el agua, mientras que la alta salinidad incrementa la densidad del agua, impidiendo que materiales menos densos, como las partículas de plásticos y poroplas, se hundan y formen parte del ecosistema bentónico de la laguna.
Además, las propiedades físicas y químicas del agua, tales como la temperatura, el pH y la salinidad, juegan un papel crucial en la dinámica de los microplásticos. La alta densidad del agua salina, en particular, facilita la flotabilidad de las partículas plásticas, manteniéndolas en suspensión y reduciendo su incorporación en los organismos bentónicos como Crassostrea Rhizophorae.
Es también relevante, considerar el comportamiento alimentario de Crassostrea Rhizophorae y su capacidad de filtración. Los organismos filtradores pueden exhibir selectividad en la ingestión de partículas, prefiriendo ciertas formas y tamaños, lo cual puede explicar la ausencia de microplásticos en sus tejidos. Estudios adicionales que evalúen la selectividad de ingestión y las tasas de filtración podrían proporcionar una comprensión más profunda de esta dinámica.
Estos hallazgos subrayan la necesidad de continuar investigando los factores ambientales que afectan la distribución de microplásticos en los ecosistemas acuáticos y su potencial impacto en la biota marina. Entender estos procesos es esencial para desarrollar estrategias efectivas de mitigación y gestión de la contaminación por microplásticos, protegiendo así la salud de los ecosistemas y las especies que los habitan.
En los análisis realizados, no se observó la presencia de microplásticos en los tejidos blandos de los ostiones de mangles (Crassostrea rhizophorae). Este resultado puede deberse a la alta densidad del agua, la cual hace que las partículas de microplásticos floten, manteniéndolas en suspensión y fuera del alcance de los organismos bentónicos como los ostiones. Estos hallazgos contrastan con los resultados de otros estudios, como el realizado por Baltazar, Flores y Reyes (2021), quienes encontraron niveles de microplásticos en Crassostrea gigas que oscilaban entre 10.18 y 11.72 partículas por individuo.
La diferencia en los resultados puede estar relacionada con los hábitats específicos de cada especie. Mientras que Crassostrea rhizophorae habita en el fondo de los manglares, un entorno bentónico donde la sedimentación puede ser más estable, Crassostrea gigas se encuentra en la parte superficial de la columna de agua en diferentes ecosistemas, donde las partículas de microplásticos pueden estar más concentradas y accesibles para la filtración.
Además, factores como la velocidad de la corriente, la salinidad y otros parámetros físicos y químicos del agua pueden influir en la distribución y concentración de microplásticos, afectando su disponibilidad para los organismos filtradores. La dinámica del flujo de agua y la interacción con los sedimentos también juegan un papel crucial en la forma en que los microplásticos son transportados y depositados en diferentes hábitats acuáticos.
Estos resultados subrayan la necesidad de realizar estudios más detallados y comparativos en diversos ambientes y con distintas especies de bivalvos, para entender mejor las variaciones en la contaminación por microplásticos y su impacto en la biota marina. La comprensión de estos procesos es fundamental para desarrollar estrategias efectivas de gestión y mitigación de la contaminación por microplásticos en los ecosistemas acuáticos.
CONCLUSIONES
A partir de 1,296.073 m³ de agua filtrada utilizando una red Bongo de 65 micrómetros en la barra de Houn Sond, situada al sur de la laguna de Bluefields, se identificaron microplásticos en diversas tonalidades: blanco hueso (0.329 g), blanco transparente (0.042 g), azul (0.028 g), y una combinación de colores variados en cantidades menores agrupadas (0.072 g). Adicionalmente, se detectó una partícula de goma con un peso de 0.022 g. La suma total del peso de los microplásticos encontrados asciende a 0.475 g, con la mayor cantidad correspondiente al color blanco hueso.
La ausencia de microplásticos en los tejidos blandos de los ostiones de mangle (Crassostrea rhizophorae) indica que estos organismos no representan un riesgo para los consumidores de la zona y las comunidades aledañas. Esta ausencia podría estar relacionada con la alta densidad del agua, que mantiene las partículas de microplásticos en suspensión, impidiendo su sedimentación y bioacumulación en los ostiones.
En el estudio de 100 metros de playa, se identificaron microplásticos de diferentes colores: blanco hueso (13.473 g), blanco transparente (5.232 g), azul (1.041 g), verde/celeste (1.346 g), y colores variados (2.190 g), siendo el blanco hueso el de mayor concentración. También, se encontraron fibras (0.360 g) y partículas de poroplas (0.193 g). En total, se identificaron 23.282 g de microplásticos en las partículas de arena de la zona estudiada.
No se observaron microplásticos en los tejidos blandos de los ostiones de mangles (Crassostrea rhizophorae). Este resultado negativo puede atribuirse a la densidad del agua, que favorece la flotación de las partículas de microplásticos, manteniéndolas en circulación. Durante el estudio, no se detectó la presencia de microplásticos en las muestras de sedimento tomadas del sitio adyacente a la zona de muestreo de arena y agua filtrada.
REFERENCIAS
Aranda, D. A., Oxenford, H. A., Medina, J., Delgado, G., Díaz, M. E., Samano, C., ... & Bouchon, C. (2022). Widespread microplastic pollution across the Caribbean Sea confirmed using queen conch. Marine Pollution Bulletin, 178, 113582.
Baltazar Flores, D. C., & Reyes, Y. (2021). Evaluación de la presencia de microplásticos en bivalvos marinos. Perú.
Cabrera, D. (2018). Determinación de la presencia de microplásticos en playas de Tenerife (Doctoral dissertation, Tesis de pregrado, Universidad de La Laguna Tenerife]. RIULL. http://riull. ull. es/xml ui/handle/915/8703).
Ebanks Mongalo, B. F., Moody Garth, S. N., Rivas Suazo, E. G., Siu Estrada, E. A., & Flores-Pacheco, J. A. (2024). Contaminación por macrobasura marina en la barra de Hong Sound, Bluefields, Costa Caribe Sur de Nicaragua. Wani, 80. https://doi.org/10.5377/wani.v40i80.17761
Ebanks Mongalo, B. F., Suárez Sánchez, J., Siu Estrada, E., Montoya Arguello, J. J., Mairena Valdivia, D. A., Flores-Pacheco, J.A., Van Der Wal, J. C. & Valencia Quintana, P. (2015). Concentración de plaguicidas en agua, sedimentos y ostiones (Crassostrea rizophorae) de la Laguna de Bluefields, RAAS, Nicaragua. Wani, 67(0), 49–54. https://doi.org/10.5377/wani.v67i0.1889
Flores-Pacheco, J. A., Lazo Sánchez, W. J., & Méndez Sevilla, J. J. (2019). Necesidades hídricas del frijol (Phaseolus vulgaris L.) INTA rojo en condiciones del trópico húmedo de Nicaragua. La Calera, 19(32), 16–23. https://doi.org/10.5377/calera.v19i32.8436
Flores-Pacheco, J. A., Mairena, Á., & Espluga, J. (2013). Evaluación de riesgos en sistemas agrícolas asociados a la utilización de plaguicidas en el Municipio de Kukra Hill, Nicaragua, Centroamérica. Nexo Revista Científica, 26(1), 34–44. https://doi.org/10.5377/nexo.v26i1.1034
Frias, J., Pagter, E., Nash, R., O'Connor, I., Carretero, O., Filgueiras, A. & Gerdts, G. (2018). Standardised protocol for monitoring microplastics in sediments. Deliverable 4.2.
García, S. (2009). Referencias históricas y evolución de los plásticos. Revista Iberoamericana de polímeros, 10(1), 71-80.
Gasperi, J., Dris, R., Bonin, T., Rocher, V., & Tassin, B. (2014). Assessment of floating plastic debris in surface water along the Seine River. Environmental Pollution, 195, 163–166. https://doi.org/10.1016/j.envpol.2014.09.001
Gutierrez Rojas, H. A. (2016). Estrategias de muestreo: diseño de encuestas y estimación de parámetros: Vol. I.
Guzzetti, E., Sureda, A., Tejada, S., & Faggio, C. (2018). Microplastic in marine organism: Environmental and toxicological effects. Environmental Toxicology and Pharmacology, 64, 164–171. https://doi.org/10.1016/j.etap.2018.10.009
Herrera, A., Liria Loza, A., Ostiategui, P., & Gómez, M. (2017). Los microplásticos: la amenaza de los ecosistemas marinos. Okeanos.
IBM. (2022). Manual de SPSS 27 (IBM, Ed.; 1o).
Invemar (2017). Protocolo de muestreo y análisis de microplásticos en aguas marinas superficiales, sedimentos de playas y tracto digestivo de peces. Componente 5: diagnóstico de microplásticos en zonas costeras de Colombia, Resolución 646 Ministerio de Ambiente y Desarrollo Sostenible.
Instituto Nicaragüense de Estudios Territoriales (INETER). (2015). Los Ecosistemas de Nicaragua y su Estrategia.
Jabeen, K., Su, L., Li, J., Yang, D., Tong, C., Mu, J., & Shi, H. (2017). Microplastics and mesoplastics in fish from coastal and fresh waters of China. Environmental Pollution, 221, 141–149. https://doi.org/10.1016/j.envpol.2016.11.055
Li, J., Yang, D., Li, L., Jabeen, K., & Shi, H. (2015). Microplastics in commercial bivalves from China. Environmental Pollution, 207, 190–195. https://doi.org/10.1016/j.envpol.2015.09.018
Mathalon, A., & Hill, P. (2014). Microplastic fibers in the intertidal ecosystem surrounding Halifax Harbor, Nova Scotia. Marine Pollution Bulletin, 81(1), 69–79. https://doi.org/10.1016/j.marpolbul.2014.02.018
Matus-Román, K. O., González-Alemán, N., & Flores-Pacheco, J. A. (2020). Comunidades de macroinvertebrados: bio-indicadores de la calidad del agua en el Territorio Indígena Rama-Kriol. Ciencia e Interculturalidad, 27(02), 129–146. https://doi.org/10.5377/rci.v27i02.10438
Muriel, A. (2020). Detección y monitoreo de microplásticos en sedimentos costeros de marismas de la costa norte del estuario de bahía blanca (Doctoral dissertation, Tesis de maestría, Universidad Tecnológica Nacional]. https://ria. utn. edu. ar/handle/20.500. 12272/4633).
Pilco Sucasaire, J., & Ticona Vilcapaza, R. (2023). Métodos estadísticos: guía básica para el uso de la estadística inferencial en investigación: Vol. 1o.
Reed, S., Clark, M., Thompson, R., & Hughes, K. A. (2018). Microplastics in marine sediments near Rothera Research Station, Antarctica. Marine Pollution Bulletin, 133, 460–463. https://doi.org/10.1016/j.marpolbul.2018.05.068
Rezania, S., Park, J., Md Din, M. F., Mat Taib, S., Talaiekhozani, A., Kumar Yadav, K., & Kamyab, H. (2018). Microplastics pollution in different aquatic environments and biota: A review of recent studies. Marine Pollution Bulletin, 133, 191–208. https://doi.org/10.1016/j.marpolbul.2018.05.022
Rodríguez Perera, G. R. (2019). Detección de microplásticos en mejillón (Mytilus edulis) de la costa atlántica uruguaya.
Suárez Miranda, I. Y., Castillo Aguilar, J. del S., Ruíz Acevedo, T. V., & Flores-Pacheco, J. A. (2022). Experiencia exitosa en la gestión de residuos sólidos en el Colegio San José, de la ciudad de Bluefields. Revista Universitaria del Caribe, 28(01), 85–93. https://doi.org/10.5377/ruc.v28i01.14448
Thompson, R. C., Olsen, Y., Mitchell, R. P., Davis, A., Rowland, S. J., John, A. W. G., McGonigle, D., & Russell, A. E. (2004). Lost at sea: Where is all the plastic? Science, 304(5672), 838. https://doi.org/10.1126/science.1094559
Vásquez, D., Molina, A., & Duque, G. (2021). Spatial distribution and increase of microplastics over time in sediments of Buenaventura Bay, Colombian Pacific. Boletín de Investigaciones Marinas y Costeras, 50(1), 27–42. https://doi.org/10.25268/bimc.invemar.2021.50.1.1021
Vidal, L., Molina Sandoval, A. E., & Duque, G. (2021). Incremento de la contaminación por microplásticos en aguas superficiales de la bahía de Buenaventura, Pacífico colombiano. Boletín de Investigaciones Marinas y Costeras, 50(2), 113–132. https://doi.org/10.25268/bimc.invemar.2021.50.2.1032
Kovač Viršek, M., Palatinus, A., Koren, Š., Peterlin, M., Horvat, P., & Kržan, A. (2016). Protocol for Microplastics Sampling on the Sea Surface and Sample Analysis. Journal of Visualized Experiments, 118. https://doi.org/10.3791/55161
Zarate, M., & Iannacone, J. (2021). Microplásticos en tres playas arenosas de la costa central del Perú. Revista De Salud Ambiental, 21(2), 123–131. Recuperado a partir de https://ojs.diffundit.com/index.php/rsa/article/view/1079
© 2024 Revista Científica Estelí.
![]() Este trabajo está licenciado bajo una Licencia Internacional Creative Commons 4.0 Atribución-NoComercial-CompartirIgual.
Este trabajo está licenciado bajo una Licencia Internacional Creative Commons 4.0 Atribución-NoComercial-CompartirIgual.
