RESUMEN
En este trabajo se evaluarán los logros y desafíos en el control administrativo de las actividades de farmacovigilancia en unidades del Instituto Nicaragüense de Seguridad Social (INSS) durante 2024. Para ello, se realizó un estudio cuantitativo, descriptivo y transversal en diez unidades de salud, aplicando un cuestionario a 46 profesionales de la salud, una guía de observación de procesos administrativos y un checklist de evaluación de vacunatorios basado en las guías ICH E2E y Q9. Los hallazgos indicaron avances significativos en el control administrativo: todas las unidades cumplieron con los plazos de notificación de eventos adversos, utilizaron efectivamente la plataforma NotiFACEDRA y demostraron un alto nivel de cumplimiento de la Normativa 063 del Ministerio de Salud. Asimismo, el 90 % de las unidades mantuvo registros adecuados de eventos adversos. No obstante, se identificaron desafíos, como la ausencia de auditorías sistemáticas, la carencia de indicadores de desempeño y limitaciones en la retroalimentación entre niveles de gestión. Se concluye que las unidades participantes en el estudio han logrado avances relevantes en la consolidación de un sistema de farmacovigilancia eficiente y normativamente alineado, sentando las bases para fortalecer la calidad de los procesos administrativos orientados a la seguridad del paciente.
Palabras Clave:
Farmacovigilancia, eventos adversos, seguridad, control sanitario, administración.
ABSTRACT
This study will evaluate the achievements and challenges in the administrative control of pharmacovigilance activities in units of the Nicaraguan Social Security Institute (INSS) during 2024. To this end, a quantitative, descriptive and cross-sectional study was carried out in ten health units, applying a questionnaire to 46 health professionals, an observation guide of administrative processes and a Vaccination evaluation checklist based on the ICH E2E and Q9 guidelines. The findings indicated significant progress in administrative control: all units met the deadlines for reporting adverse events, effectively used the NotiFACEDRA platform, and demonstrated a high level of compliance with Ministry of Health Regulation 063. Additionally, 90% of the units maintained adequate records of adverse events. However, challenges were identified, such as the absence of systematic audits, lack of performance indicators, and limited feedback between management levels. It is concluded that INSS has achieved meaningful progress in consolidating an efficient and regulation-aligned pharmacovigilance system, laying the groundwork for strengthening the quality of administrative processes focused on patient safety
Key Words:
Pharmacovigilance, adverse events, safety, sanitary control, administration.
INTRODUCCIÓN
La farmacovigilancia, definida por la Organización Mundial de la Salud (OMS) como la ciencia y las actividades relacionadas con la detección, evaluación, comprensión y prevención de los efectos adversos o cualquier otro problema relacionado con los medicamentos, vacunas, dispositivos médicos o cosméticos1 , constituye un pilar fundamental para garantizar la seguridad del paciente y la calidad de la atención sanitaria. En los sistemas de salud contemporáneos, su correcta implementación no solo protege a los usuarios de los medicamentos, sino que también fortalece la confianza pública en los productos farmacéuticos y contribuye a la mejora continua de las prácticas clínicas.
En este sentido, la farmacovigilancia no puede concebirse como una actividad aislada, sino como un proceso estructurado que depende de una adecuada aplicación de los principios administrativos: planificación, organización, dirección y control. Estos procesos administrativos permiten establecer un marco de actuación ordenado y coherente, garantizando que la farmacovigilancia se integre de manera efectiva en el funcionamiento cotidiano de las unidades de salud. De ellos, el control constituye una función estratégica, ya que implica la verificación sistemática del cumplimiento de los procedimientos establecidos, la identificación de desviaciones y la implementación de medidas correctivas que aseguren la calidad de las actividades de farmacovigilancia.
A nivel global, los esfuerzos por fortalecer los sistemas de farmacovigilancia han estado acompañados por la adopción de estándares internacionales, como las guías ICH E2E sobre gestión del riesgo de medicamentos y las buenas prácticas de farmacovigilancia promovidas por la Organización Panamericana de la Salud (OPS)2 . Sin embargo, en América Latina, muchos países enfrentan retos significativos, entre ellos la debilidad en los procesos administrativos internos, la fragmentación de responsabilidades y la limitada disponibilidad de recursos humanos capacitados en vigilancia de medicamentos y vacunas3 .
En Nicaragua, el Instituto Nicaragüense de Seguridad Social (INSS) ha asumido el desafío de fortalecer su sistema de farmacovigilancia a través de la incorporación progresiva de los procesos administrativos como eje articulador de su funcionamiento. Desde su instauración en el 2024, el sistema de farmacovigilancia del INSS ha buscado no solo cumplir con las normativas nacionales, como la Normativa 063 sobre vigilancia de medicamentos, sino también establecer mecanismos de mejora continua que permitan optimizar la identificación, notificación y gestión de eventos adversos a medicamentos (RAM) y eventos supuestamente atribuibles a vacunación o inmunización (ESAVI).
Particularmente, el control administrativo en farmacovigilancia ha mostrado avances significativos en el contexto del INSS. La implementación sistemática de la plataforma NotiFACEDRA para la notificación de eventos adversos, el cumplimiento generalizado de los plazos de reporte y la estructuración progresiva de los registros de farmacovigilancia en las unidades de salud representan logros destacados. Estos avances son especialmente relevantes si se considera que el sistema de farmacovigilancia del INSS aún se encuentra en una fase inicial de desarrollo, lo que resalta el compromiso institucional con la seguridad del paciente y la mejora de los procesos asistenciales.
El presente estudio tiene como objetivo analizar los principales logros y desafíos en el control administrativo de la farmacovigilancia en algunas unidades de salud del INSS durante el año 2024, enfatizando los aspectos positivos alcanzados y reconociendo las áreas de oportunidad que aún requieren fortalecimiento. La evaluación de este proceso resulta crucial para consolidar un sistema de farmacovigilancia eficaz, sostenible y alineado con los estándares internacionales, garantizando la protección de la población usuaria y el fortalecimiento de la calidad de los servicios de salud en Nicaragua.
MATERIALES Y MÉTODOS
Se llevó a cabo un estudio cuantitativo, descriptivo y transversal en diez unidades de salud adscritas al Instituto Nicaragüense de Seguridad Social (INSS), distribuidas en cinco departamentos del país, lo que constituyó la población objeto del estudio. Para la obtención de la información, se contó con la participación de 46 profesionales que actuaron como informantes clave, seleccionados por su responsabilidad directa en los procesos de farmacovigilancia (directores de unidad, jefes de enfermería, regentes farmacéuticos, responsables del PAI, médicos asistenciales y supervisores de farmacovigilancia).
Se utilizaron tres instrumentos de recolección de datos:
- Cuestionario estructurado: instrumento aplicado al personal de salud para evaluar su percepción sobre el cumplimiento de los procedimientos, el uso de la plataforma NotiFACEDRA, el mantenimiento de registros y la gestión de eventos adversos.
- Guía de observación: utilizada para registrar de manera directa el cumplimiento de actividades vinculadas al control administrativo, la disponibilidad de documentación y la asignación de roles.
- Checklist de evaluación de vacunatorios: basado en las guías ICH E2E y Q9, y en la Normativa 121 del Ministerio de Salud de Nicaragua, permitió valorar aspectos operativos del control, como la trazabilidad de eventos adversos y la aplicación de medidas correctivas.
El procesamiento de los datos se realizó utilizando Microsoft Excel versión Office 2016, mediante análisis de frecuencias, proporciones y comparación descriptiva de los resultados entre unidades de salud. Se aplicó la triangulación metodológica para integrar la información proveniente de los distintos instrumentos y garantizar una interpretación más completa de los hallazgos.
Durante todas las etapas del estudio se cumplieron los principios éticos de la investigación científica, asegurando el consentimiento informado de los participantes, la confidencialidad de los datos. La investigación fue autorizada por los responsables del área de farmacovigilancia del INSS y se enmarcó en las normativas nacionales vigentes sobre ética en investigación en salud.
RESULTADOS
Se evaluaron diez unidades de salud del Instituto Nicaragüense de Seguridad Social (INSS) entre mayo y diciembre de 2024, abarcando aspectos críticos del control administrativo en farmacovigilancia. La información se obtuvo mediante la aplicación de cuestionarios, guías de observación y listas de verificación diseñadas según estándares internacionales de buenas prácticas (ICH E2E, OPS).
1. Cumplimiento de los plazos de notificación de eventos adversos
En todas las unidades de salud evaluadas (100 %), se verificó que los eventos adversos a medicamentos (RAM) y eventos supuestamente atribuibles a vacunación o inmunización (ESAVI) fueron notificados dentro de los plazos establecidos por la normativa nacional vigente (Normativa 063 del MINSA), que indica un plazo máximo de 24 horas para eventos graves y hasta 21 días para eventos no graves. La disciplina en el cumplimiento de los tiempos de reporte sugiere un grado importante de madurez en los procedimientos internos de vigilancia, pese a la reciente instauración del sistema.
2. Uso efectivo de la plataforma NotiFACEDRA
El 100 % de las unidades de salud registraron los eventos adversos utilizando la plataforma NotiFACEDRA, herramienta nacional que permite la notificación digital de sospechas de RAM y ESAVI. Este resultado refleja un avance tecnológico importante en la gestión de la farmacovigilancia, promoviendo la trazabilidad, el acceso en tiempo real a la información y el cumplimiento de estándares de calidad.
3. Existencia de registros actualizados de eventos adversos
Se observó que nueve de las diez unidades (90 %) mantenían registros actualizados de los eventos adversos notificados. Esta práctica es fundamental para garantizar la continuidad de los procesos de evaluación de la seguridad de medicamentos y vacunas, y evidencia un avance organizativo en el sistema interno de farmacovigilancia del INSS.
4. Designación de responsables de farmacovigilancia
En nueve unidades (90 %) se identificó formalmente a un responsable de farmacovigilancia. La existencia de una figura definida para la supervisión y gestión de eventos adversos permite fortalecer la vigilancia activa, mejorar la respuesta institucional y promover la cultura de seguridad dentro de las unidades de salud.
5. Organización y flujo de trabajo de farmacovigilancia
Respecto a la organización del flujo de trabajo, ocho de las diez unidades (80%) demostraron poseer procedimientos sistematizados que garantizan la notificación oportuna y la adecuada gestión de eventos adversos. No obstante, en dos unidades (20%) se evidenciaron dificultades asociadas principalmente a la rotación del personal y la falta de definición clara de funciones.
En referencia a el flujo de trabajo en las unidades de salud en relación con las actividades de farmacovigilancia, se encontró que:
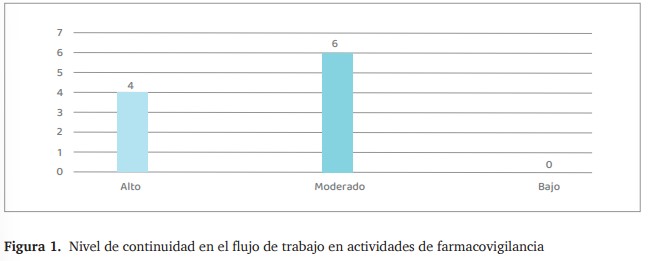
- Cuatro unidades de salud mostraron un flujo de trabajo alto, es decir, las actividades de farmacovigilancia se realizaban sin interrupciones y con una ejecución organizada. En estas unidades, los procedimientos de notificación y seguimiento se desarrollaban de manera sistemática, con una distribución clara de responsabilidades y tiempos adecuados para la gestión de eventos adversos, (figura .1).
- Seis unidades de salud presentaron un flujo de trabajo moderado, donde se identificaron algunas interrupciones en los procesos de farmacovigilancia. Estas interrupciones se debían, principalmente, a la asignación de tareas adicionales al personal, lo que limitaba el tiempo disponible para la notificación y el seguimiento de eventos adversos. A pesar de estas dificultades, las actividades de farmacovigilancia se mantenían activas, aunque con oportunidades de mejora en la optimización del tiempo y la distribución de funciones.
6. Retrasos en el flujo de trabajo de farmacovigilancia
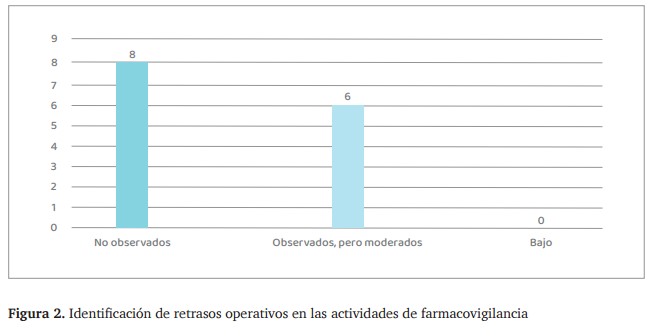
Se observó el desarrollo de las actividades de farmacovigilancia dentro de las unidades de salud para identificar posibles interrupciones o demoras en los procesos administrativos relacionados con la notificación, seguimiento y análisis de eventos adversos.
- Ocho unidades de salud no presentaron retrasos en sus procesos administrativos de farmacovigilancia (figura.2). En estas unidades, las actividades de notificación y registro de eventos adversos se realizaban en los tiempos establecidos, con personal disponible para la ejecución de estas tareas sin interferencias en su flujo de trabajo.
- Dos unidades de salud experimentaron retrasos moderados en el desarrollo de las actividades de farmacovigilancia. Estos retrasos fueron atribuidos principalmente a la carga laboral del personal responsable de la farmacovigilancia, quienes además de estas funciones, debían asumir otras tareas dentro de la unidad de salud. En algunos casos, la farmacovigilancia se realizaba de manera intermitente, dependiendo de la disponibilidad del personal para completar los registros y notificaciones.
7. Percepción del personal de salud sobre la efectividad del control del proceso administrativo en farmacovigilancia
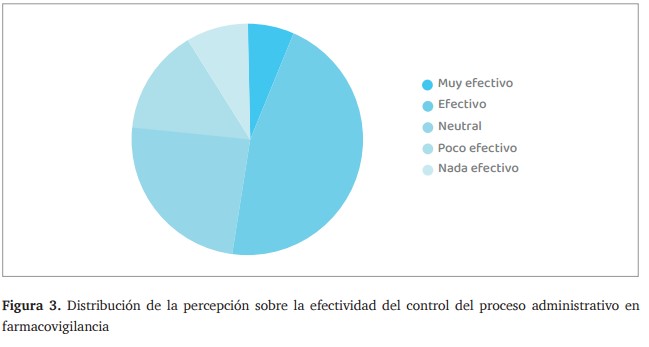
En relación con la percepción de los encuestados sobre la efectividad del control del proceso administrativo en las actividades de farmacovigilancia, los resultados fueron los siguientes:
- 3 (6.5%) lo consideran muy efectivo.
- 21 (45.7%) lo califican como efectivo.
- 11 (23.9%) tienen una percepción neutral.
- 7 (15.2%) lo consideran poco efectivo.
- 4 (8.7%) señalaron que el control en farmacovigilancia es nada efectivo.
Estos datos muestran que el 52.2% de los encuestados considera que el control del proceso administrativo en farmacovigilancia es efectivo o muy efectivo, mientras que un 23.9% lo percibe como deficiente o con oportunidades de mejora, (figura 3).
8. Desafíos y áreas de oportunidad
Aunque los logros son significativos, la evaluación también identificó algunas limitaciones que podrían comprometer la consolidación del sistema a mediano plazo:
- Falta de auditorías internas periódicas para validar la calidad y exhaustividad de los reportes de eventos adversos.
- Ausencia de indicadores de desempeño formales que permitan medir la eficiencia de las actividades de farmacovigilancia en cada unidad.
- Debilidad en la retroalimentación entre niveles de atención, afectando en ciertos casos el seguimiento de eventos graves o recurrentes.
Estas limitaciones son consistentes con el carácter incipiente del sistema de farmacovigilancia en el INSS, y representan oportunidades de mejora en el marco de un proceso de fortalecimiento continuo.
En la (tabla 1) se sintetizan los principales hallazgos obtenidos en la evaluación del control administrativo del sistema de farmacovigilancia en las unidades de salud del INSS. Los resultados reflejan logros importantes, como el cumplimiento del 100% en los plazos de notificación de eventos adversos y la adopción total de la plataforma NotiFACEDRA. Asimismo, se destacan áreas que requieren fortalecimiento, como la implementación de auditorías internas y la definición de indicadores de desempeño, aspectos esenciales para consolidar un sistema de farmacovigilancia robusto y sostenible.

Los resultados muestran que el sistema de farmacovigilancia del INSS ha incorporado prácticas de notificación y control administrativo en las unidades de salud. Se observó adherencia a los plazos de notificación, uso de la plataforma NotiFACEDRA y asignación de responsables de farmacovigilancia en la mayoría de las unidades. También se identificó la ausencia de auditorías internas y la falta de indicadores de desempeño en algunas unidades.
DISCUSIÓN
El presente estudio evaluó la implementación de los procesos administrativos en farmacovigilancia en unidades de salud del Instituto Nicaragüense de Seguridad Social (INSS) durante su primer año de funcionamiento. La farmacovigilancia es una herramienta esencial para garantizar la seguridad de los pacientes y la calidad de los tratamientos médicos4 . Su eficacia depende de la implementación estructurada de mecanismos que aseguren la vigilancia continua, entre los cuales el control administrativo juega un rol estratégico al verificar el cumplimiento, identificar desviaciones y permitir mejoras sostenidas5,6.
Los resultados mostraron que, a pesar de la reciente instauración del sistema, se han alcanzado logros significativos. El cumplimiento del 100% en los plazos de notificación de eventos adversos, así como la adopción total de la plataforma NotiFACEDRA en las unidades evaluadas, constituyen indicadores de un avance importante hacia la consolidación de una cultura de seguridad en el manejo de medicamentos7 . Asimismo, la asignación de responsables de farmacovigilancia y la disponibilidad de registros actualizados evidencian compromiso con la trazabilidad y la respuesta técnica ante riesgos sanitarios8 .
Diversos estudios han demostrado que la existencia de canales electrónicos de notificación mejora la eficiencia de los sistemas de farmacovigilancia, al facilitar el reporte oportuno y disminuir las barreras administrativas6 . Estos avances se corresponden con los lineamientos de la OMS para fortalecer la vigilancia de medicamentos en países en desarrollo9 , en los que la capacitación del personal y la disponibilidad de plataformas tecnológicas son elementos clave en etapas tempranas de implementación10.
Sin embargo, se identificaron áreas críticas que requieren atención urgente para garantizar la sostenibilidad del sistema. Entre ellas destaca la ausencia de auditorías internas estructuradas y la falta de indicadores de desempeño, elementos necesarios para un control administrativo efectivo11. La carencia de auditorías limita la capacidad del sistema para identificar desviaciones, implementar acciones correctivas y mejorar la calidad del proceso12. Esta debilidad ha sido documentada en estudios internacionales que recomiendan el uso de métricas claras para monitorear aspectos como la oportunidad y calidad del reporte13,14.
La comunicación fluida entre niveles y la supervisión continua también son factores determinantes para un control efectivo. Experiencias en países con sistemas más maduros destacan que la participación activa de los equipos directivos fortalece la cultura de reporte y permite tomar decisiones basadas en datos7,4.
La falta de indicadores en farmacovigilancia ha sido reportada como una de las principales debilidades en estudios de evaluación de sistemas emergentes13,14. La literatura recomienda establecer métricas claras que permitan monitorear aspectos como la tasa de notificación, la oportunidad en el reporte y la calidad de los reportes15,16.
Finalmente, aunque el control administrativo ha mostrado avances importantes en el cumplimiento de los procedimientos básicos, su sostenibilidad a largo plazo dependerá de la incorporación sistemática de auditorías internas y de indicadores de gestión que permitan evaluar la eficacia del sistema de forma continua. Estas herramientas no solo facilitarían la detección de fallas o desviaciones, sino que también contribuirían a fortalecer una cultura institucional de mejora permanente en las actividades de farmacovigilancia4 .
En este estudio, los hallazgos corresponden exclusivamente a las unidades evaluadas, considerando que la selección se realizó por conveniencia según su participación activa en farmacovigilancia. El diseño transversal permitió cumplir con el objetivo planteado al describir el estado actual del control administrativo en farmacovigilancia dentro de estas unidades.
A pesar de estas limitaciones, los hallazgos permiten concluir que el sistema de farmacovigilancia del INSS ha logrado sentar bases sólidas en su primer año de operación. Con la implementación de acciones correctivas específicas en las áreas identificadas, el sistema podría evolucionar hacia niveles de madurez más avanzados, asegurando así una vigilancia efectiva de la seguridad de los medicamentos y vacunas administrados a la población5,6.
En este contexto, la experiencia del INSS constituye un ejemplo valioso de cómo un sistema de farmacovigilancia emergente puede progresar de manera sostenida cuando existe un compromiso institucional real, una gestión técnica adecuada y una apertura a la mejora continua basada en evidencia científica7,8.
CONCLUSIONES
El estudio evidenció que el sistema de farmacovigilancia del Instituto Nicaragüense de Seguridad Social (INSS) ha incorporado procesos administrativos esenciales dentro de sus unidades de salud. Se confirmó el uso sistemático de la plataforma NotiFACEDRA, el cumplimiento oportuno en la notificación de eventos adversos y la presencia de personal responsable para la gestión de la farmacovigilancia. Estos elementos han permitido fortalecer la trazabilidad de los reportes y mejorar la organización de las actividades.
La mayoría de los profesionales encuestados percibe que el control administrativo es efectivo, lo cual respalda la operatividad del sistema en su etapa actual. No obstante, se observaron diferencias en la aplicación de ciertos procedimientos, especialmente en unidades con mayor carga asistencial.
Aún persisten aspectos a desarrollar, como la implementación de auditorías internas y la definición de indicadores que permitan medir el desempeño y asegurar la mejora continua. La consolidación de estas acciones contribuirá a evaluar el progreso del sistema y orientar decisiones institucionales.
En general, el sistema de farmacovigilancia del INSS se encuentra en una fase de fortalecimiento gradual. La continuidad de la capacitación, el acompañamiento técnico y el seguimiento periódico serán clave para alcanzar mayores niveles de madurez y sostenibilidad en el tiempo.
AGRADECIMIENTOS
Agradezco al equipo de farmacovigilancia del Instituto Nicaragüense de Seguridad Social (INSS) y a los profesionales de las unidades de salud participantes por su apoyo en la recolección y validación de la información. Extiendo mi agradecimiento a la MSc. Martha Barrera por su orientación durante la elaboración de este artículo y a la UNAN-Managua por el acompañamiento académico brindado.
REFERENCIAS BIBLIOGRÁFICAS
- World Health Organization. The Importance of Pharmacovigilance: Safety Monitoring of Medicinal Products. Geneva: WHO, Geneva; 2002.
- International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH). ICH Harmonised Tripartite Guideline E2E: Pharmacovigilance Planning. International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH), Geneva; 2004.
- Ministerio de Salud de Nicaragua. Normativa para la Vigilancia de Reacciones Adversas a Medicamentos y Vacunas (Normativa 063). MINSA; 2025.
- European Medicines Agency. Guideline on good pharmacovigilance practices (GVP) Module XVI – Risk minimisation measures (Rev 3). ; 2016.
- Montastruc JL, Sommet A, Lacroix I, Oliver P, Bagheri H, Lapeyre-Mestre M. Pharmacovigilance for evaluating adverse drug reactions: value, organization, and methods. Joint Bone Spine. 2006; 73(6): p. 629-632.
- Wordl Healht Organization. Reporting and learning systems for medication errors: the role of pharmacovigilance centres. Geneva: WHO; 2014.
- Olson S. The role of the WHO Programme for International Drug Monitoring in coordinating worldwide drug safety efforts. Drug Safety; 1998.
- Al-Zubiedi SA, Younus , Al-Khalidi , Ekilo , Al-Shami A. Pharmacovigilance regulatory actions by national pharmacovigilance centers in Arab countries following COVID-19 pandemic. Drug Safety: Expert Opinion. 2022; 21(10): p. 1367–1376.
- Edwards IR, Aronso JK. Adverse drug reactions: definitions, diagnosis, and management. ; 2000.
- Bahri P, Pariente A. Systematising Pharmacovigilance Engagement of Patients, Healthcare Professionals, and Regulators: A Practical Decision Guide Derived from the International Risk Governance Framework for Engagement Events and Discourse. Drug Safety; 2021.
- Ndagije HB, Walusimbi , Atuhaire , Ampaire. Drug safety in Africa: a review of systems and resources for pharmacovigilance. Drug Safety. 2023; 22(1): p. 59-71.
- Adu-Gyamfi PK, Boadu Mensah , Ocansey , Moomin. Assessment of knowledge, practices, and barriers to pharmacovigilance among nurses at a teaching hospital, Ghana: a cross sectional study. BMC Nurse. 2022; 124(21).
- Zhao Z, Zhang X, Wang Z, Ma Z, Liu D. An investigation of pharmacovigilance and reporting of adverse drug reactions in hospitals: a cross-sectional study in China. Curr Med Res Opin. 2021; 37(2): p. 199-206.
- Sharma B. Pharmacovigilance: monitoring and reporting adverse drug reactions. The Pharma Innovation Journal. 2019; 8(1): p. 223-226.
- European Medicines Agency (EMA). Guideline on good pharmacovigilance practices (GVP) Module I – Pharmacovigilance systems and their quality systems. Londres: EMA; 2012.
- Organización Panamericana de la Salud. Buenas Prácticas de Farmacovigilancia para las Américas (Red PARF Documento Técnico No. 5).. , Washington, D.C.; 2011.
