



Ciencias
Viabilidad de esporas de Aspergillus awamori immovilizado en Criogeles
Viability of spores of Aspergillus awamori immobilized in cryogels
Revista Torreón Universitario
Universidad Nacional Autónoma de Nicaragua-Managua, Nicaragua
ISSN: 2410-5708
ISSN-e: 2313-7215
Periodicidad: Cuatrimestral
vol. 10, núm. 29, 2021
Recepción: 24 Julio 2020
Aprobación: 27 Mayo 2021
Financiamiento
Fuente: Vice-Rectoría de Investigación, Posgrado y Extensión Universitaria, de la UNAN-Managua a través de los Fondos para Proyectos de Investigación (FPI)
Beneficiario: Dra. María Teresa Plata Oviedo y coautores Lic. Zulma Pérez y Dra. Martha Lacayo Romero

Resumen: El trabajo consistió en inmovilizar esporas de Aspergillus awamori en alcohol polivinílico (PVA) a diferentes concentraciones 10, 12, y 15 % (p/v). La viabilidad de las esporas inmovilizadas fue comparada con las esporas libres, por el método convencional de conteo en placas. La técnica de inmovilización fue por atrapamiento y consistió en una suspensión de esporas en el polímero y luego fue congelada a -18 ºC por 24 horas. La viabilidad fue similar en esporas inmovilizadas y libres; esto indica que probablemente no hay efectos de toxicidad por el polímero y que la exposición a bajas temperaturas no daña la estructura de las esporas. La fuga de esporas fue diferente en cada caso de inmovilización a las 24 horas. La menor fuga fue con esporas al 15% y la mayor al 12%. A las 96 horas la menor fue con esporas inmovilizadas al 10%, seguida por 15 % y la mayor con esporas inmovilizadas al 12% manteniéndose así hasta las 120 horas.
Palabras clave: Inmovilización por atrapamiento, alcohol polivinílico.
Abstract: The work consisted of immobilizing Aspergillus awamori spores in polyvinil alcohol (PVA) at different concentrations 10, 12 y 15% (w/v). The viability of the immobilized spores was compared to the free spores, by the conventional plate counting method. The imobilization technique was by entrapment, it consisted of a suspension of spores in the polymer and then it was frozen at -18 ºC for 24 hours. Viability was similar in immobilized and frees pores, this indicates that there are probably no toxic effects of the polymer and that exposure to low temperatures does not damage the structure of the spores. Spores leakage was different in each case of immobilization at 24 hours, the least leakage was with spores at 15% and the highest at 12%. At 96 hours, the lowest was with spores immobilized at 10%, followed by 15% and the highest spores immobilized at 12%, thus remaining until 120 hours.
Keywords: Immobilization by entrapment, polivinyl alcohol.
Introducción
En las últimas décadas, la mayoría de las investigaciones en células inmovilizadas se han elaborado con soportes porosos formados alrededor de las células. Los polisacáridos y polímeros sintéticos pueden ser gelificados permitiendo el atrapamiento celular, donde la pérdida de viabilidad celular es mínima y permite una carga de biomasa alta; obteniéndose diferente forma y diámetros del poros en el criogel donde varía de 1 a 1.5 mm. (E. N. Efremenko et al., 2006).
La técnica de atrapamiento en geles con polímeros naturales es una técnica donde el daño a las células es minimizado. La desventaja es la poca resistencia mecánica y la limitada permanencia de la estructura del gel que es fácilmente destruida por el desarrollo celular y la producción de dióxido de carbono (CO2), así como en la immobilización en la aplicación en los procesos de tratamientos de aguas residuales (Willaert & Baron, 1996).
La aplicación de polímeros sintéticos para la inmovilización de células vivas tiene beneficios comparado con los polímeros naturales por la porosidad, propiedades iónicas, hidrofóbicas o hidrofílica y su resistencia mecánica.
El alcohol polivinílico es una materia prima de vinilo y es un material de bajo costo, no tóxico para los microorganismos y, puede utilizarse para atrapar células vivas. La solución se vuelve gelatinosa por congelación y la resistencia del gel aumenta durante las interacciones de congelación y descongelación.
Los criogeles en alcohol polivinílico, que se preparan por congelación-descongelación de soluciones acuosas concentradas del polímero, poseen ventajas definidas en comparación con otros hidrogeles comúnmente utilizados para los mismos fines. Beneficios similares son los siguientes: (i) los criogeles de alcohol polivinílico tienen micro y macroporosidades muy altas que proporcionan condiciones favorables para la transferencia de masa sin impedimentos de sustratos y metabolitos; (ii) las características reológicas de la matriz no fragmentaria son excelentes y permiten el uso de estos portadores en la mayoría de los tipos de reactores; (iii) la termoestabilidad de los criogeles de alcohol polivinílico excede la de otros portadores de gel termorreversibles comúnmente utilizados; (iv) los criogeles son altamente resistentes a la degradación biológica, además de ser de baja sensibilidad a las composiciones de medios de cultivo; (v) El alcohol polivinílico en sí es un polímero de bajo costo biológicamente compatible, no tóxico y fácilmente disponible (Lozinsky & Plieva, 1998).
La inmovilización de células se puede definir como “el confinamiento físico o la localización de células intactas en una región sin pérdida de la actividad biológica deseada (El-Mansi et al., 2011)
La propuesta del uso de criogeles en microbiología se estima que inició desde 1980, cuando fueron sugeridos como matrices para inmovilización celular por la técnica de atrapamiento mecánico. Sin embargo, su aplicación fue realizada recientemente. Generalmente la inmovilización de microorganismos vía atrapamiento mecánico consiste en una suspensión de esporas o pellet mezclada homogéneamente con el polímero y luego sometidas a temperaturas bajo cero (Lozinsky & Plieva, 1998).
El principal objetivo de este trabajo fue demostrar que las esporas de Aspergillus awamori podían ser inmovilizadas en alcohol polivinílico, su viabilidad fue evaluada por el método convencional de conteo en placas. La viabilidad de las esporas inmovilizadas en alcohol poli vinílico a diferentes concentraciones (10, 12 y 15 % p/v) fue comparada con las esporas en estado libre. El procedimiento de inmovilización fue sencillo, consistió en una suspensión de esporas en el polímero, se homogenizó y se criogelizó a -18 ºC por 24 horas.
Los resultados demuestran que la técnica de inmovilización por atrapamiento es prometedora y no afecta la viabilidad de las esporas del microorganismo. Sin embargo, es necesario en futuros estudios evaluar los parámetros cinéticos y metabólicos.
Metodología
El presente trabajo de investigación fue realizado en el área de Microbiología del Laboratorio de Biotecnología de la Universidad Nacional Autónoma de Nicaragua, Managua (UNAN-Managua).
El aislamiento de Aspergillus awamori, se hizo de muestras de suelos contaminados por la actividad minera artesanal en Nicaragua, en el departamento de Chontales (Santo Domingo). Los hongos fueron cultivados en placas con agar PDA + Cloranfenicol a 27 ± 1 ºC durante cinco días.
Conteo de esporas
Para el conteo de esporas se utilizó cámara Neubauer y microscopio Trinocular BX43 con aumento de 40X. La suspensión de esporas se hizo por la técnica de arrastre, se homogenizó en tubos de ensayo de 16 x 150 mm con 10 ml de agua destilada estéril y se agitó durante 15 segundos en Vórtex a 150 rpm, con micropipetas automáticas se midieron 20 ul para realizar el conteo. La densidad de esporas con las que se trabajó fue de 1x106 esporas/ml, tanto para esporas libres como inmovilizadas. El resultado se expresó en número de esporas por ml. (E. Efremenko et al., 2006)
Inmovilización de esporas de Aspergillus awamori
Se utilizó alcohol polivinílico (peso molecular es de 85,000-124,000 99% + % deshidrolizado,) homogenizado con esporas a tres concentraciones (p/v) de 10%, 12% y 15%, esterilizado a 121 ºC por 15 minutos. El procedimiento para suspender las esporas fue el mismo utilizado en el conteo de esporas.
La suspensión de las esporas (1x106) a la solución de alcohol polivinílico fue homogenizada, luego transferida en tubos falcon de 25 ml, conteniendo moldes plásticos de 2.5 x 2.5 cm. La criogelización se efectuó a -18 ºC por 24 horas, en un termostato Fisher Scientific Isotemp 6200 R28 previamente calibrado a -18 ºC y acondicionado con alcohol al 96%.
Activación
Para la activación de las esporas se utilizaron Erlenmeyer de 1000 ml, conteniendo 500 ml de medio de cultivo compuesto por (g/litro): Glucosa 120; (NH4)2 SO4, 3.0; MgSO4 x 7H2O, 0.3; ZnSO4 x 7H2O, 0.05; KH2PO4, 0.2. Se ajustó a pH 6.0 y se esterilizó a 121ºC por 15 minutos. Para suspender los moldes con las esporas inmovilizadas a diferentes concentraciones de alcohol polivinílico (10%, 12%, 15%) previamente cortadas y lavadas con agua destilada estéril. El objetivo de activar las esporas es para que se adapten a su nueva temperatura de germinación y se reproduzcan (E. Efremenko et al., 2006).
La aeración del cultivo de esporas inmovilizadas y libres, se realizó en agitador orbital (AO-400 Bunsen, España) a 100 rpm. Para garantizar la temperatura, el agitador se introdujo en incubadora Fisher Scientific Isotemp 3720A a 30 ºC durante cuatro días. Este procedimiento se hizo por triplicado.
Viabilidad de esporas
Para determinar la viabilidad de las esporas se utilizaron Erlenmeyer de 250 ml (conteniendo 100 ml de medio de cultivo) para suspender los moldes con las esporas inmovilizadas y activadas a diferentes concentraciones de PVA, así como la viabilidad de esporas libres, la aireación de las esporas inmovilizadas y libres, se realizó en agitador orbital (AO-400 Bunsen, España) a 100 rpm. Para garantizar la temperatura, el agitador se introdujo en incubadora Fisher Scientific Isotemp 3720A a 30 ºC durante cinco días. Este procedimiento se hizo por triplicado. El medio cultivo utilizado fue el mismo de la activación (g/l): Glucosa 120; (NH4)2 SO4, 3.0; MgSO4 7H2O, 0.3; ZnSO4 7H2O, 0.05; KH2PO4, 0.2. Se ajustó a pH 6. 0. Este procedimiento se hizo por triplicado.
Viabilidad de esporas inmovilizadas y libres
Las esporas viables se determinaron por conteo en placa, sin diluciones sucesivas (la inoculación fue directa del Erlenmayer a la placa) por duplicado, se inoculó 0.5 ml de medio de cultivo en placas conteniendo agar PDA, las muestras se colectaron cada 24 horas por cinco días.
Resultados
En la figura 1 se observa la viabilidad de esporas libres e inmovilizadas de Aspergillus awamori. La fase exponencial de las esporas libres (control) fue después de las 72 horas para las concentraciones de alcohol polivinílico de 12 y 15 (% p/v). La fase exponencial de las esporas inmovilizadas al 12 (% p/v) fue similar a las libres. Las esporas inmovilizadas al 15 (% p/v) iniciaron su fase exponencial a las 24 horas, pero su fase de declinación fue aproximadamente a las 96 horas, este comportamiento se debe probablemente a que por el tamaño de los poros del criogel hubo mejor transferencia de sustratos y otros elementos. Las esporas libres y las inmovilizadas al 10 (% p/v), se comportaron de manera similar en su fase exponencial, sin embargo, el retraso en su fase exponencial es una desventaja en comparación a las esporas inmovilizadas a mayores concentraciones de alcohol polivinílico, si las esporas de Aspergillus awamori se utilizaran en microbiología industrial, habría que valorar si la enzima que se desea obtener será extracelular o endocelular. Si se van aplicar en biorremediación tendría que evaluarse si conviene mayor o menor duración de la etapa de adaptación del microorganismo. En un estudio realizado con Rhizopus orizae donde sus esporas fueron inmovilizadas en alcohol polivinílico se evaluaron sus parámetros cinéticos y metabólicos. Los resultados demuestran que las esporas inmovilizadas se desarrollan un poco más lento que las libres (E. Efremenko et al., 2006).
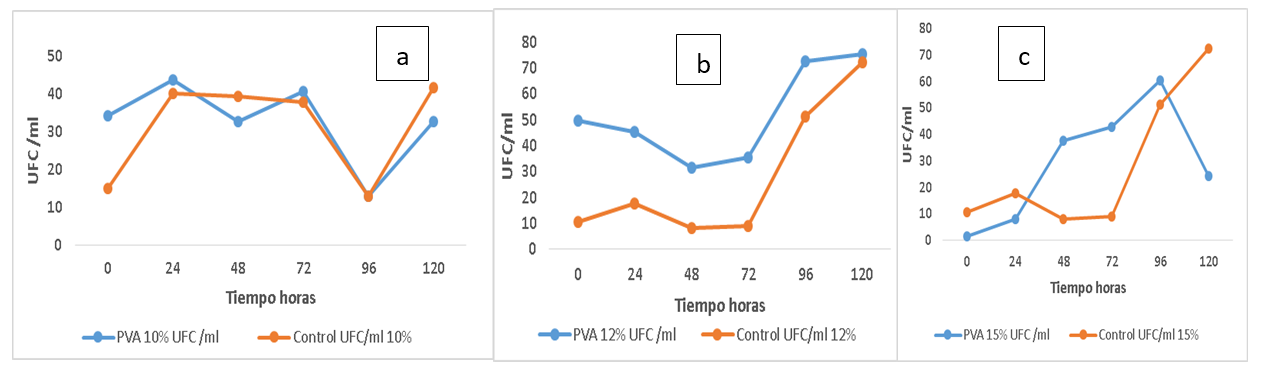
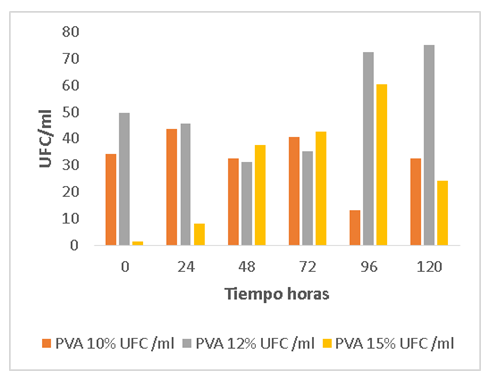
En la figura 2 se observa la viabilidad de las esporas con tres concentraciones de alcohol polivinílico (PVA). A las 24 horas la menor fuga de esporas de los poros del polímero fue a 15 %, después de las 72 horas el comportamiento varió completamente, a las 96 horas la mayor fuga de esporas fue con PVA 12% y la menor con PVA 10%. Este comportamiento está estrechamente relacionado con la curva de crecimiento de Aspergillus awamori, la transferencia de nutrientes y el tamaño de los poros después de la criogelización.
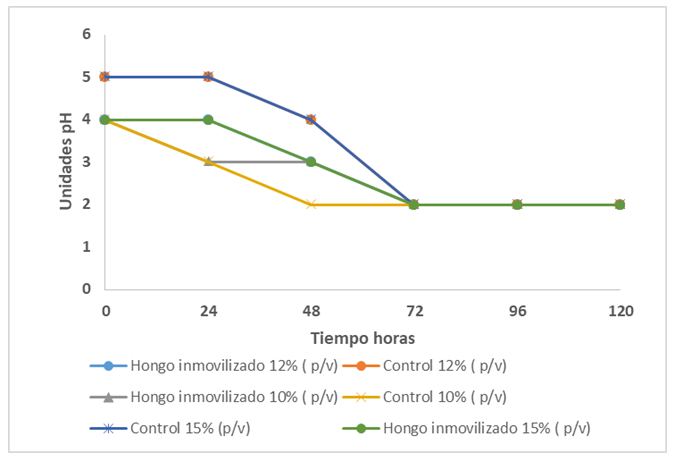
En la figura 3 se observa que el pH decreció después de las 24 horas en todos los casos, a las 48 horas el pH registrado fue de 2 en todos los ensayos. El cambio de pH va asociado con los parámetros metabólicos y cinéticos lo que indica que el sustrato fue consumido.
Discusión
La diferencia entre los parámetros cinéticos y metabólicos de esporas libres e inmovilizadas atrapadas en PVA no fue evaluado en este trabajo. Efremenko analiza comparativamente estos parámetros en Rizophus orizae inmovilizado en PVA, la productividad de las células inmovilizadas y libres las asocia a las limitaciones de las transferencias de masa entre las células inmovilizadas y libres. Probablemente, el macro poro creado durante la criogelización del polímero determina la formación de una estructura interna con menor densidad celular, pero con mayor accesibilidad a sustrato y a la oxigenación.(E. Efremenko et al., 2006)
Las diferentes concentraciones del polímero influyen directamente en su porosidad. La combinación de propiedades, la estructura controlada de los macro poros, biocompatibilidad, propiedades químicas y mecánicas dan la apertura a nuevas aplicaciones en Microbiología. (Plieva et al., 2008)
La variación en la viabilidad de las esporas inmovilizadas probablemente se deba al tamaño de los poros que está determinado directamente por la concentración del polímero y la temperatura a la cual se criogelizó el polímero con la suspensión celular. Al comparar la viabilidad de esporas inmovilizadas y libres en cada caso nos demuestra que la concentración del polímero y la temperatura no afectan su viabilidad, sin embargo, es necesario en futuros estudios medir los parámetros cinéticos y metabólicos de ambos casos.
Conclusiones
La técnica de atrapamiento y criogelización es prometedora para aplicaciones en Microbiología industrial y ambiental, podría también ser aplicada como un método de preservación de microorganismos.
Es un precedente de técnicas de inmovilización no invasiva, no tóxica, económica y de fácil elaboración.
Agradecimientos
A la Vice-Rectoría de Investigación, Posgrado y Extensión Universitaria y a la Dirección de Investigación de la UNAN-Managua, por el financiamiento de los Fondos para Proyectos de Investigación (FPI), proceso No.24201604.
A la Lic. Martha Jarquín Pascua, Coordinadora Técnica del Laboratorio de Biotecnología de la UNAN-Managua, por su incondicional colaboración técnica durante el proceso de investigación.
A la Ing. Anyela Fernández Salazar, Responsable de la Delegación Territorial de Minas, Dirección General de Minas y a los propietarios de las Rastras Sr. Adonis González y Rodrigo Miranda en Santo Domingo-Chontales por proporcionar los sedimentos necesarios para la investigación.
Al Prof. MSc. Marbell Aguilar Maradiaga del Laboratorio de Cultivo de Tejidos Vegetales de la Universidad Nacional Agraria por proporcionar equipos necesarios para la culminación de la investigación desarrollada en el Laboratorio de Biotecnología.
Bibliografía
Efremenko, E. N., Spiricheva, O. V., Veremeenko, D. V., Baibak, A. V., & Lozinsky, V. I. (2006). L(+)-lactic acid production using poly(vinyl alcohol)-cryogel-entrapped Rhizopus oryzae fungal cells. Journal of Chemical Technology and Biotechnology, 81(4), 519–522. https://doi.org/10.1002/jctb.1524
Efremenko, E., Spiricheva, O., Varfolomeyev, S., & Lozinsky, V. (2006). Rhizopus oryzae fungus cells producing L(+)-lactic acid: Kinetic and metabolic parameters of free and PVA-cryogel-entrapped mycelium. Applied Microbiology and Biotechnology, 72(3), 480–485. https://doi.org/10.1007/s00253-005-0297-y
El-Mansi, E. M. T., Stephanopoulos, G., & Carlson, R. P. (2011). Flux control analysis and stoichiometric network modeling: Basic principles and industrial applications. Fermentation Microbiology and Biotechnology, Third Edition, December 2011, 165–200. https://doi.org/10.1201/b11490-13
Lozinsky, V. I., & Plieva, F. M. (1998). Poly(vinyl alcohol) cryogels employed as matrices for cell immobilization. 3. Overview of recent research and developments. Enzyme and Microbial Technology, 23(3–4), 227–242. https://doi.org/10.1016/S0141-0229(98)00036-2
Plieva, F. M., Galaev, I. Y., Noppe, W., & Mattiasson, B. (2008). Cryogel applications in microbiology. Trends in Microbiology, 16(11), 543–551. https://doi.org/10.1016/j.tim.2008.08.005
Willaert, R. G., & Baron, G. V. (1996). Gel entrapment and micro-encapsulation: Methods, applications and engineering principles. Reviews in Chemical Engineering, 12(1–2), 160–205. https://doi.org/10.1515/revce.1996.12.1-2.1

