



Ciencias
Fluctuaciones del pH, alcalinidad, oxígeno disuelto y nutriente en Cayos Miskitos, municipio de Puerto Cabezas, Región Autónoma del Atlántico Norte (RAAN)
Fluctuations of pH, alkalinity, dissolved oxygen and nutrient in Cayos Miskitos, municipality of Puerto Cabezas, Autonomous Region of the North Atlantic (RAAN)
Revista Torreón Universitario
Universidad Nacional Autónoma de Nicaragua-Managua, Nicaragua
ISSN: 2410-5708
ISSN-e: 2313-7215
Periodicidad: Cuatrimestral
vol. 10, núm. 29, 2021
Recepción: 17 Julio 2020
Aprobación: 22 Junio 2021
Financiamiento
Fuente: Fondo para Proyectos de Investigación (FPI), que otorga la Universidad Nacional Autónoma de Nicaragua (UNAN-Managua)
Beneficiario: Yader Santiago Caballero Arbizú

Resumen: La acidificación de océanos es el descenso del pH causado por la absorción del dióxido de carbono antropogénico producido por la combustión de combustibles fósiles, entre otras actividades humanas, aumentando la acidez del agua y disminuyendo la disponibilidad de los carbonatos, lo que amenaza la supervivencia de especies marinas calcáreas: corales, ostras, cangrejos y langostas, entre otros. Estos efectos constituyen una amenaza en el Caribe de Nicaragua, por lo que se realizó un monitoreo de parámetros físico-químicos del agua en Cayos Miskitos (Puerto Cabezas, Región Autónoma del Atlántico Norte, RAAN) en julio, septiembre y noviembre del 2018; febrero y marzo del 2019. Los muestreos se realizaron con la colaboración de técnicos de IREMADES-URACCAN. Los parámetros físicos – químicos medidos fueron: pH, alcalinidad total, oxígeno disuelto y nutrientes; se analizaron por métodos estándares. El pH presentó valores normales para el agua de mar (8,05 y 8,19 unidades de pH), mientras la alcalinidad mostró valores ligeramente por encima de los valores típicos del agua del mar (118 a 124 mg/l-1 como CaCO3). Las concentraciones del NTD en todos los sitios muestreados representaron aproximadamente el 50% de las concentraciones del NT, mientras la presencia del FT, FTD y FRD se debe al fenómeno del afloramiento a la superficie de aguas más profundas. Estos resultados destacan la importancia de estudiar el pH y la alcalinidad para conocer su impacto en la evolución de la acidificación del océano y sus efectos para apoyar políticas tendientes a mitigar los fenómenos de calentamiento y adaptación al cambio climático.
Palabras clave: Acidificación de océanos, alcalinidad, nutrientes, parámetros físicos – químicos.
Abstract: Ocean acidification is the drop in pH caused by the absorption of anthropogenic carbon dioxide produced by the combustion of fossil fuels, among other human activities, increasing the acidity of water and decreasing the availability of carbonates, which threatens the survival of Calcareous marine species: corals, oysters, crabs and lobsters, among others. These effects constitute a threat in the Nicaraguan Caribbean, so a monitoring of the physical-chemical parameters of the water was carried out in Cayos Miskitos (Puerto Cabezas, Autonomous Region of the North Atlantic, RAAN) in July, September and November 2018; February and March 2019. The samplings were carried out with the collaboration of IREMADES-URACCAN technicians. The physical-chemical parameters measured were: pH, total alkalinity, dissolved oxygen and nutrients; they were analyzed by standard methods. The pH presented normal values for seawater (8.05 and 8.19 pH units), while alkalinity showed values slightly above the typical values for seawater (118 to 124 mg / l-1 as CaCO3). NTD concentrations at all sampled sites represented approximately 50% of NT concentrations, while the presence of FT, FTD and FRD is due to the phenomenon of outcrop to the surface of deeper waters. These results highlight the importance of studying pH and alkalinity to know its impact on the evolution of ocean acidification and its effects to support policies aimed at mitigating the phenomena of warming and adaptation to climate change.
Keywords: Ocean acidification, alkalinity, nutrients, physical - chemical parameters.
1. INTRODUCCIÓN
La acidificación del océano es el descenso en el curso del pH en los océanos de la Tierra, causado por la absorción de dióxido de carbono antropogénico desde la atmósfera. Se estima que desde la revolución industrial el pH ha disminuido en 0,1 unidades, tendencia que en los últimos decenios se ha mantenido con un ritmo de -0,0014 a -0,0024 por año (IPCC, 2013).
Las actividades humanas tales como, los cambios en los usos del suelo, la combustión de combustibles fósiles y la producción de cemento ha supuesto un nuevo aporte de dióxido de carbono (CO2) a la atmósfera. El océano desempeña un rol importante en la absorción del CO2 atmosférico, Cuando el CO2 es absorbido por el océano reacciona con el agua y se forma un equilibrio entre especies químicas iónicas y no iónicas: el CO2 libre en disolución, el ácido carbónico (H2CO3), el bicarbonato (HCO3-) y el carbonato (CO32-). Un gran aumento del CO2 disminuye el pH del agua de la superficie del mar aumentando la acidez, disminuyendo la disponibilidad de carbonatos, lo que amenaza la supervivencia de muchas especies marinas, principalmente a los organismos calcáreos tales como los corales, estrellas marinas, ostras, cangrejos, gambas, mejillones, langostas y otras especies marinas como las comunidades de macro algas, praderas de pastos marinos y los ecosistemas de manglares (Waycott et al, 2007; Brierley & Kingsford, 2009; Porzio, Buia, & Hall. 2011; Comeaux, Mead, & Bianchi, 2012; Jennerjahn, 2012).
Los principales efectos de la acidificación del agua, así como el ascenso del nivel del mar, constituye amenazas potenciales para los ecosistemas en las áreas marítimas del Caribe de Nicaragua, porque muchas familias dependen de la pesca, por lo que se debe conservar y preservar la salud del ecosistema. Según Humbolt (2008), de cada diez productos del mar exportados por Nicaragua, cinco provienen de la región autónoma del Caribe, por lo cual, resulta importante desarrollar programas de monitoreo de la calidad del agua en Cayos Miskitos en el mar Caribe, con el objetivo de conocer las fluctuaciones del pH, alcalinidad, oxígeno disuelto y nutriente y crear una base de datos que permita, para contribuir a la exploración de las señales de acidificación del océano y de su impacto en los ecosistemas marinos y costeros en el territorio marítimo del Caribe.
2. METODOLOGIA
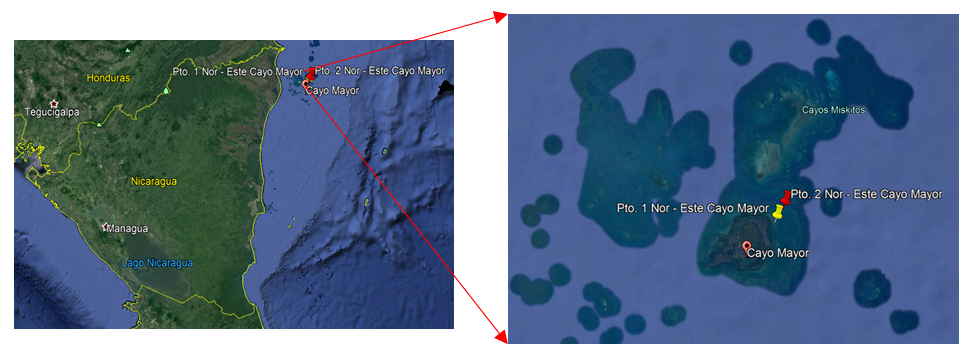
Los Cayos Miskitos se encuentran ubicados en la zona noreste de Nicaragua, municipio de Puerto Cabezas, Región Autónoma del Atlántico Norte (RAAN), a una distancia aproximada de 560 km de la ciudad de Managua. Para la estimación de la acidificación del océano se realizaron mediciones puntuales en diversos períodos de parámetros físicos y químicos en el agua en dos sitios de estudio en Cayos Miskitos. Las muestras fueron colectadas siguiendo las recomendaciones del Proyecto RLA7020 “Estudio de línea base para la evaluación de la acidificación en el Caribe de Nicaragua utilizando técnicas nucleares e isotópicas”, en Cayos Miskitos (Puerto Cabezas) en los meses de julio, septiembre y noviembre del 2018; febrero y marzo del 2019, en dos sitios de muestreo: Pto 1. noreste Cayo Mayor Miskitos y Pto 2. noreste Cayo Mayor Miskitos (Fig. 1).
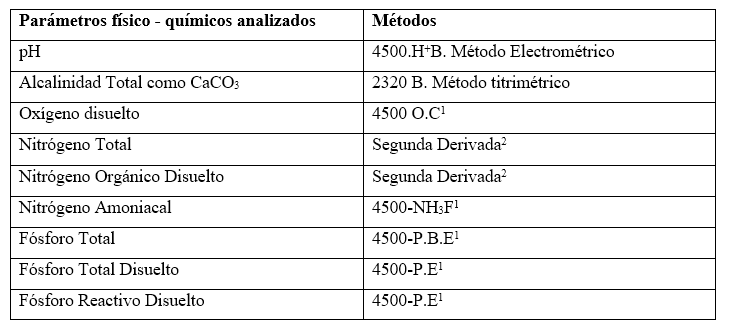
Se realizó la toma de muestras de agua por medio de una botella Van Dorn para realizar análisis de pH, alcalinidad total, oxígeno disuelto (OD) y nutriente (nitrógeno total (NT), nitrógeno total disuelto (NTD), nitrógeno amoniacal (N-NH3), fósforo total (FT), fósforo total disuelto (FTD), fósforo reactivo disuelto (FRD). Las muestras de agua fueron colectadas y preservadas siguiendo los procedimientos de campo por técnicos y especialistas de University of Autonomic Region of the Nicaraguan Caribbean Coast (URACCAN), posteriormente fueron transportadas para ser analizadas siguiendo los Procedimientos Operativos Normalizados (PON) del laboratorio de Aguas Naturales del CIRA/UNAN de acuerdo al Standard Methods for the Examination of Water and Wastewater. 22 nd Edition (Tabla 1). Como prueba de calidad para los análisis físicos y químicos se establecieron pruebas de recuperación de estándares para verificar el buen rendimiento de las técnicas analíticas, blancos, muestras control y duplicados.
3. RESULTADOS Y DISCUSION
3.1. pH
Los valores de pH en los 2 meses estudiados en el Pto 1 alcanzaron un valor mínimo de 8,03 en septiembre 2018 y un máximo de 8,19 en marzo 2018, mientras en los 4 meses muestreados en el Pto 2 el pH registró un valor mínimo de 8,05 en septiembre 2018 y febrero 2019 y un máximo en marzo 2019, coincidiendo los máximos en el Pto 1 y Pto 2 en marzo 2019 (Fig. 2).
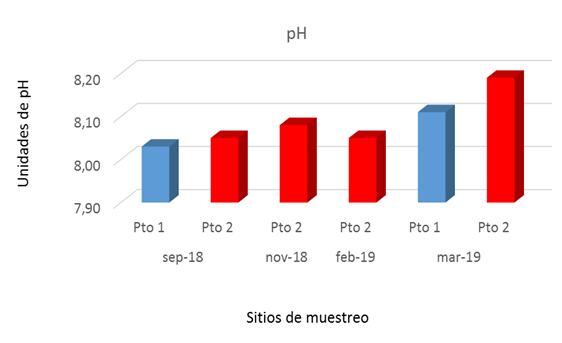
En general, el agua de mar es ligeramente alcalina y el valor de su pH está entre 7,5 y 8,4 unidades de pH y varía en función de la temperatura; si ésta aumenta, el pH disminuye y tiende a la acidez; también, puede variar en función de la salinidad, la presión o profundidad y la actividad vital de los organismos marinos (Cifuentes, Torres, & Frías, 1997). El comportamiento del pH en los dos sitios muestreados en este estudio se encuentra entre los valores normales para el agua de mar. El Pto 2 mostró un aumento significativo en marzo 2019 en ambos sitios muestreados, siendo ligeramente alcalinas al compararlo con los sitios muestreados en este estudio.
En el agua de mar los aniones HCO3- y CO32- presentan altas concentraciones que dan origen a pH alcalino entre 7,5 y 8,5 unidades de pH (De La Lanza Espino, 2001). Cabe señalar que los valores obtenidos de pH en todos los sitios muestreados podrían estar relacionados a incrementos de temperaturas del agua, lo que favoreció los procesos de precipitación del CaCO32- y que explicaría el pH obtenido en este estudio. El pH en todos los meses muestreados no tuvo cambios importantes en el tiempo y el espacio. El pH encontrado en este estudio es similar al reportado por (Delvalls, 1999) en zonas más distantes de la costa el cual encontró valores de pH de 8,3 unidades de pH.
3.2. Alcalinidad
Los valores de la alcalinidad encontrada son bastante similares en el Pto 1 y Pto 2 en todos los meses muestreados con un valor promedio de 86,83 mg.l-1 y 101,45 mg.l-1 respectivamente (Fig. 3). El Pto 2 presentó los valores más altos de alcalinidad con 124 mg.l-1 en noviembre 2018 y 124,01 mgl-1 en febrero 2019. Esta situación podría reflejar un aumento en la productividad trayendo como resultado una mayor eliminación del CO2 de la columna de agua (Delvalls, 1999) que aunado a incrementos de temperatura del agua favorecerían los procesos de precipitación del CaCO32- y que a la vez explicaría los valores de pH encontrados en este estudio.
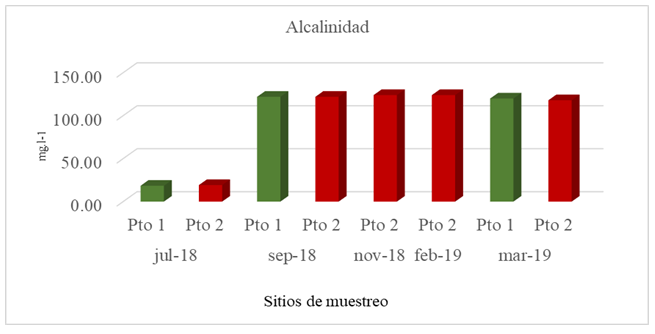
El balance de las formas iónicas, bicarbonato y carbonato está controlado por el pH, encontrándose que a pH altos entre 7,00 y 9,00 unidades de pH predominan los bicarbonatos (De La Lanza Espino, 2001). La alcalinidad depende esencialmente de las concentraciones de bicarbonatos, carbonatos e hidróxidos (Ramírez & Viña, 1998). Los componentes primarios de la alcalinidad de los sistemas acuáticos, el carbonato y el bicarbonato estabilizan el pH cerca de 8 que es benéfico para la mayoría de las plantas acuáticas y animales; por tanto, la alcalinidad encontrada en los Pto 1 y Pto 2 en este estudio está fuertemente relacionada con el pH encontrado en todos los sitios muestreados (8,03 – 8,19 unidades de pH). La alcalinidad encontrada en este estudio se encuentra ligeramente por encima de los valores del agua del mar que establece una alcalinidad total de 100 ppm CaCO3 (Custodio & Llamas, 2001).
3.3. Oxígeno Disuelto
El oxígeno disuelto (OD) se considera una de las variables más importantes para la supervivencia de los peces y otros organismos de vida acuática dentro del agua de mar (Bustos, 2003). Las concentraciones de OD encontradas en todos los sitios muestreados en la época lluviosa y seca presentaron un mínimo de 7,50 mg.l-1 en febrero 2019 y un máximo de 12,06 mg.l-1 en noviembre 2018 y marzo 2018 (Fig.4). Las concentraciones más altas de OD en este estudio fueron encontradas en el Pto 2 en comparación con los registrados en el Pto 1. El comportamiento del OD en este estudio podría estar relacionado a la circulación de las masas de agua, actividad fotosintética, temperatura, salinidad y al equilibrio con la cantidad que existe en la atmósfera siendo sus valores altos.
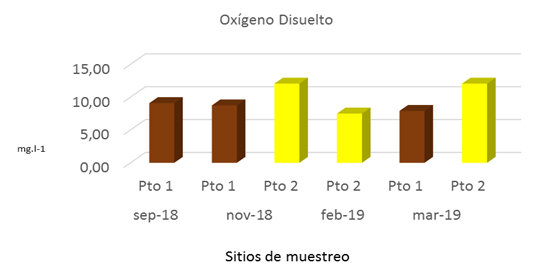
Las concentraciones de OD obtenidas durante el estudio fueron óptimas para la biota acuática con valores entre 7,50 mg.l-1 y 12,06 mg.l-1. El comportamiento del oxígeno disuelto en esta investigación varió con respecto al encontrado por CIMAB (2010), el cual mostró valores entre 6,20 mg l-1 y 7,06 mg l-1. Es relevante mencionar, que la variabilidad de los niveles de oxígeno disuelto en el mar se presenta en dependencia de las temperaturas de las distintas zonas geográficas y las concentraciones de oxígeno disuelto son mayores o aumentan en la medida que se alejan de la costa. Los valores mínimos que se encuentran en las zonas de afloramiento son de 1 ml/l y en las zonas de gran fotosíntesis es común encontrar valores de 8,5 ml/l (Bustos, 2003).
3.4. Nutrientes
3.4.1. Nitrógeno
• Nitrógeno Total
El nitrógeno es el gas que se encuentra en mayor proporción en el mar, pero por su carácter inerte no interviene en el ciclo biológico de las sustancias nitrogenadas, aunque existen en el mar ciertas bacterias que son capaces de producirlo y otras de fijarlo (Cifuentes, Torres, & Frías, 1997). El Nitrógeno Total (NT) en el Pto 1 varió entre 1,245 mgl-1 a 4,737mg.l-1, mientras en el Pto 2 osciló entre 2,096 mg.l-1 a 7,986 mg.l-1, obteniéndose en ambos sitios de muestreo el valor más alto en noviembre 2018 (Fig.5).
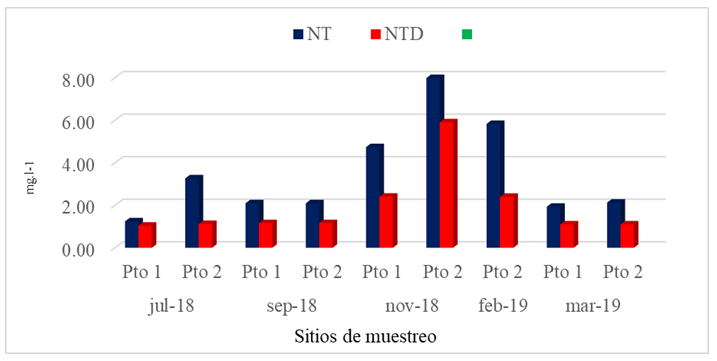
En general, la concentración total promedio de nitrógeno en el océano es de 11,5 ppm, de la cual 11 ppm es en forma de N2 (CCO, 2013). En esta investigación el NT mostró un patrón definido para los meses de julio 2018, septiembre 2018 y marzo 2019, sin embargo, presentó cambios en sus concentraciones para los meses de noviembre 2018 y febrero 2019. La distribución del nitrógeno depende de la temperatura, la salinidad, la circulación de los procesos de mezcla (los nutrientes salen nuevamente a la superficie, por corrientes de agua ascendentes, que se producen al cambiar la temperatura de las diferentes masas de agua, en las llamadas zonas de surgencia o afloramiento, donde es tomado por los organismos en la zona fotica), la difusión que se realiza en las aguas oceánicas y por las excreciones y muerte de los vegetales y animales marinos (Cifuentes, Torres, & Frías, 1997). Esta situación evidencia que el NT en noviembre 2018 y febrero 2019 en los Pto 1 y Pto 2 sale nuevamente a la superficie, por corrientes de agua ascendentes, por las excreciones y muerte de los vegetales y animales marinos. Las concentraciones de NT en este estudio fueron más altas al compararlas con las encontradas en CIMAB (2010) porque presentaron un patrón de distribución horizontal heterogéneo, con valores extremos que oscilaron entre 1,524 mg.l-1 y 0,753 mg.l-1.
• Nitrógeno Total Disuelto (NTD)
Las concentraciones de Nitrógeno Total Disuelto (NTD) en el Pto 1 oscilaron entre 1,043 mg.l-1 a 2,406 mg.l-1, mientras que para el Pto 2 las concentraciones variaron entre 1,102 mg.l-1 a 5,903 mg.l-1 (Fig.5). Es importante señalar que en ambos puntos de muestreo se presentaron las concentraciones más altas en el mes de Noviembre 2018, siendo el Pto 2 el que presentó la concentración más alta de NTD para este estudio muy distante del valor promedio de 2,177 mg.l-1.
Las concentraciones del NTD en todos los sitios muestreados representaron aproximadamente el 50% de las concentraciones del NT (Fig.5). El NTD mostró un patrón de distribución muy variado entre puntos y épocas muestreadas, posiblemente ocasionado por las corrientes de agua ascendente que se producen al cambiar la temperatura en el área de estudio. De acuerdo a Cifuentes, Torres, & Frías (1997), la circulación del agua en el mar interviene en la concentración de los nutrientes.
• Nitrógeno amoniacal
Las concentraciones de nitrógeno amoniacal representaron una pequeña fracción de la concentración de nitrógeno total, indicando que la misma está representada principalmente por nitrógeno orgánico de origen reciente que contiene grandes cantidades de materia orgánica no asimilada. Los resultados de Nitrógeno Amoniacal en los Pto 1 y Pto 2 registraron variaciones entre los meses muestreados, obteniéndose los valores más alto en marzo 2019 con 0,106 mgl-1 y 0,051 mg.l-1 respectivamente (Fig.6). El Pto 1 registró los valores más altos de nitrógeno amoniacal en este estudio, obteniéndose en el mes de marzo 2019 la mayor concentración con 0,106 mg.l-1 muy por encima del valor promedio de 0,047 mg.l-1). Cabe señalar que los resultados obtenidos en ambos puntos de muestreo en las cinco campañas realizadas en el estudio representaron una pequeña fracción del nitrógeno total.
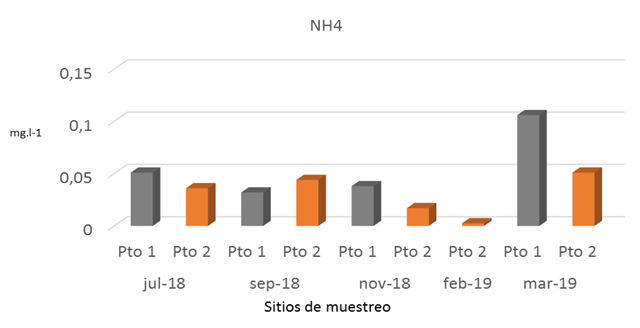
La presencia de Nitrógeno Amoniacal (N-NH3) en este estudio fue menor que la encontrada por CIMAB (2010) el cual reportó valores mayores en la mayoría de los puntos muestreados entre 0,005 mg.l-1 y 0,142 mg.l-1. Según CIMAB (2010), el nitrógeno amoniacal a pH mayores de 8,0 unidades es perjudicial para la vida de los peces; lo que no ocurrió durante este monitoreo. Es relevante mencionar, que el punto muestreado en febrero 2019 presentó valores menores que 0,005 mg.l-1 en este estudio.
3.4.2. Fósforo
• Fósforo Total
El fósforo total (FT) está compuesto por las especies de ortofosfatos (fósforo soluble), polifosfatos: pirofosfatos, tripolifosfatos y metafosfatos y fosfatos orgánicos. El FT en el Pto 1 varió entre menor que 0,016 mg.l-1 a 0,182 mgl-1, mientras en el Pto 2 varió entre menor que 0,016 mg.l-1 a 0,123 mg.l-1 (Fig.7), obteniéndose en ambos puntos de muestreo el valor más alto en septiembre 2018, siendo el Pto 1 el que presentó el valor más alto, ligeramente mayor del valor promedio obtenido en este estudio con 0,117 mg.l-1.
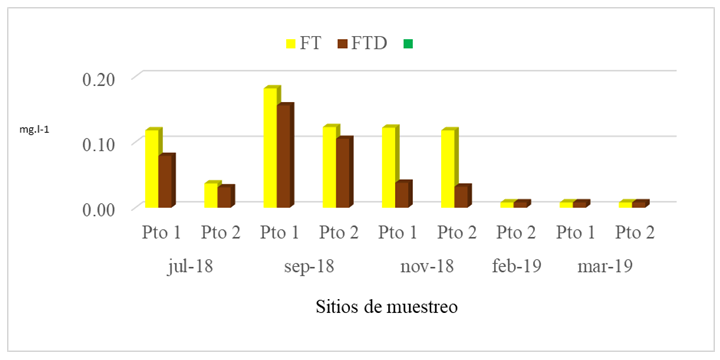
La presencia del FT en la época de invierno posiblemente se debe al fenómeno del afloramiento a la superficie de aguas más profundas. Las concentraciones de FT en esta investigación fueron similar en julio 2018, septiembre 2018 y octubre 2018 a las encontradas por CIMAB (2010), el cual reportó valores entre 0,127 mg.l-1 y 0,146 mg.l-1. Es relevante mencionar, que los puntos muestreados en febrero 2019 y marzo 2019 presentaron valores menores que 0,016 mg.l-1 en este estudio, ocasionado posiblemente por una explosión fitoplanctónica. El "bloom" o periodo de explosión fitoplanctónica trae como consecuencia una disminución del fósforo existente en el mar, ya que el intenso consumo no puede ser compensado por nuevos aportes a la misma velocidad (Cifuentes, Torres, & Frías, 1997). Cabe señalar que otros aportes de FT en el área de estudio en julio 2019 y septiembre 2019 posiblemente proceden de los restos de los seres muertos que se depositan en el fondo y sobre cuyos restos actúan las bacterias, transformándolos en elementos inorgánicos.
• Fósforo Total Disuelto
El FTD incluye especies solubles como ortofosfato, polifosfato y fósforo orgánico, así como también especies coloidales y polímeros. Las concentraciones encontradas de fósforo total disuelto (FTD), mostraron un comportamiento similar al FT porque se encontraron los valores más altos en Sept-018, siendo el Pto 1 el que presentó el valor más alto con 0,156 mg.l-1 (Fig.7), superior al valor promedio encontrado en este estudio (0,074 mg.l-1).
Las concentraciones más altas de FTD se encontraron en la época de invierno (julio 2018 y septiembre 2018) posiblemente se encontraron por influencia de afloramiento y debido a las corrientes ascendentes estos elementos se ponen en circulación hacia las capas superiores provocando la renovación de los fosfatos. Es en estas zonas donde se forman las condiciones para encontrar las concentraciones más altas de FTD durante el invierno. Según (Cifuentes, Torres, & Frías, 1997), La circulación del agua interviene en la concentración de los nutrientes y salen nuevamente a la superficie, por corrientes de agua ascendentes, que se producen al cambiar la temperatura de las diferentes masas de agua, en las llamadas zonas de surgencia o afloramiento. El comportamiento del FTD es similar al del FT en los meses de Feb-2019 y Mar-2019 debido a que las concentraciones encontradas para ambas especies están por debajo de 0.016 mg.l-1.
• Fósforo Reactivo Disuelto
El fósforo reactivo disuelto (FRD) es un nutriente de gran importancia porque es utilizado por las plantas, bacterias y algas. El FRD en ambos puntos de muestreo se encontró por debajo del límite de detección en todos los meses muestreados (0,016 mg.l-1), lo cual puede ser debido a que el mismo es reciclado muy rápidamente por lo microorganismos acuáticos o la formación de complejos, quelatos y sales insolubles con algunos metálicos que precipitan posiblemente porque es utilizado por los microorganismos acuáticos en el proceso de la fotosíntesis disminuyendo su concentración. Según CCO (2013), los fosfatos son utilizados por el fitoplancton o plancton vegetal, en los procesos de fotosíntesis, lo que hace que su concentración sea muy variable, tanto horizontal como verticalmente. Es relevante mencionar que el FRD al igual que el FT y el FTD se encontraron por debajo de 0.016 mg.l-1 en los Pto 1 y Pto 2 en febrero 2019 y marzo 2019. En general, las concentraciones de NT y FT encontradas en este estudio son mayores que las reportadas por el estudio realizado anteriormente por (CIMAB, 2010).
4. CONCLUSIONES
Los resultados de pH se encuentran entre los valores normales para el agua de mar, sin embargo, debido a la metodología usada en el análisis es probable que exista un impacto de las emisiones de CO2 en las ramificaciones para la química del océano. La alcalinidad se encuentra ligeramente por encima de los valores del agua del mar y reflejan una tendencia alcalina, lo que la relación con los valores de pH encontrados en el agua durante este estudio. La variabilidad del oxígeno disuelto en el agua del Caribe de Nicaragua posiblemente se debe a los diferentes procesos físicos, químicos y biológicos que se producen en el mar de manera continua y que está en dependencia de la temperatura y la salinidad. El comportamiento de los nutrientes muestra que intervienen corrientes de aguas ascendentes, que se producen al cambiar la temperatura de las diferentes masas de agua en las zonas llamadas afloramiento o surgencia.
Agradecimientos
Al Fondo para Proyectos de Investigación (FPI), que otorga la Universidad Nacional Autónoma de Nicaragua (UNAN-Managua), al Centro para la Investigación en Recursos Acuáticos de Nicaragua (CIRA/UNAN-Managua) por cofinanciar esta investigación y los técnicos de IREMADES-URACCAN por colaborar en la colecta de las muestras de agua y apoyar en el traslado al CIRA/UNAN-Managua.
BIBLIOGRAFIA
APHA. (2012). Standard Methods for the Examination of Water and Wastewater. Washington.
Bradley, P., Sandersona, M., Frischer, M., Brofft, J., Booth, M., Kerkhof, L., & Bronka, D. (2010). Inorganic and organic nitrogen uptake by phytoplankton and heterotrophic bacteria in the stratified Mid-Atlantic Bight. Estuarine, Coastal and Shelf Science , 429-441.
Brierley, A., & Kingsford, M. (2009). Impacts of climate change on marine organisms and ecosystems . Current Biology.
Bustos, H. (2003). Manual de Prácticas de Laboratorio en Oceanografía Química 2017-1. México
Caldeira, K., & Wickett, M. (2003). Anthropogenic carbon and ocean pH. Nature, 365.
CCO. (2013). El Océano Maravilla Terrestre . Bogota D.C: Comisión Colombiana del Océano.
Cifuentes, J., Torres, M., & Frías, M. (1997). El Océano y sus recursos. II. Las ciencias del Mar: oceanografía geológica y oceanografía química. México .
CIMAB. (2010). Programa de monitoreo de la calidad de ecosistemas marinos en zonas de alto riesgo en la región del gran caribe. "Red regional en Ciencias y Tecnologías Marinas para el caribe: Know-Why Network". Nicaragua .
Comeaux, R., Mead, A., & Bianchi, T. (2012). Mangrove expansion in the Gulf of Mexico With climate change: Implications for wetland health and resistance to rising sea levels. Estuarine, Coastal and Shelf Science, 81-95.
Crumpton, W., Isenhart, T., & Mitchell, P. (1982). Nitrate an Organic N analisis with second derivate spectroscopiy. Limnology & Oceanography .
Custodio, E., & Llamas, M. (2001). Hidrología Subterránea. Tomo I y II. Barcelona, España : Omega, S. A.
De La Lanza Espino, G. (2001). Características fisico químicas de los mares de México. México: Editores México.
Delvalls, A. (1999). Underway pH measurements in upwelling conditions: The California Current. Ciencias Marinas, 345-365.
Gómez, A. (1996). Causas de la fertilidad marina en el nororiente de Venezuela . Interciencia , 140-146.
Humbolt, C. (2008). Monitoreo ambiental de sistemas productivos . Nicaragua .
IPCC. (2013). Climate Change 2013: The Physical Science Basis. New York, USA.
Jennerjahn, T. (2012). Biogeochemical response of tropical coastal systems to present and past environmental change. Earth Science Reviews, 19-41.
Karl, D., & Michael, L. (2003). Nitrogen Cycle. Encyclopedia of Ocean Sciences, 1876-1884.
Khatiwala, S., Primeau, F., & Hall, T. (2009). Reconstruction of the history antrhropogenic CO2 concentration in the ocean . Nature .
Margalef, R. (1991). Limnología. Ecología . Barcelona : Ediciones Omega. S, A .
Marsh, G. (2005). Seawater pH and anthropogenic carbon dioxide. Chicago: Argonne National Laboratory .
Porzio, L., Buia, M., & Hall, J. (2011). Effects of ocean acidification on macroalgal communities. Journal of Experimental Marine Biology and Ecology, 278-287
Ramírez, A., & Viña, G. (1998). Limnología Colombiana aportes a su conocimiento y estadística de análisis . Colombia .
Waycott, M., Collier, C., McMahon, K., McKenzie, L., Udy, J., & Alana, G. (2007). Vulnerability of seagrasses in the Great Barrier Reef to climate change . Australia.

