ISSN 2410-5708 / e-ISSN 2313-7215
Año 9 | Núm. 25 | pág. 77 - 93 | junio – septiembre 2020
© Copyright (2020). Universidad Nacional Autónoma de Nicaragua, Managua.
Esta obra está bajo una licencia Creative Commons
Atribución-NoComercial-SinDerivar 4.0 Internacional
Remoción de plomo en solución acuosa usando criogeles basados en polyacrylamide como adsorbente: Estudio de equilibrio en modo batch
https://doi.org/10.5377/torreon.v9i25.9855
Fecha de recepción: 03 de febrero, 2020 / Fecha de aceptación: 19 de abril, 2020
Lic. Martha Jarquín Pascua
Especialista en análisis de Laboratorio
Laboratorio de Biotecnología, UNAN–Managua
Palabras clave: Criogeles MPAAG-TBA, Plomo (Pb2+), remoción, capacidad de adsorción, isotermas de equilibrio
Resumen
El objetivo de esta investigación fue remover los iones plomo (Pb2+) presentes en soluciones acuosas mediante el uso de macroporos gel de polyacriamina (MPAAG) llamado criogel, como material adsorbente. Los MPAAG, se prepararon mediante una reacción de co-polimerización por radicales libres de acrilamida (AAm) y alil glicidil éter (AGE) y N, N-metilen-bis (acrilamida) (MBAAm) unidos a grupos funcionales epóxidos (epoxy-pAAm) a una concentración de 7,5 %, cuya reacción se realizó a -12 oC por 1 horas. Después del proceso de preparación el MPAAG se evaluó mediante la unión de los grupos ligandos del tris (2aminoethyl) amine (TREN) seguido del ácido bromoacético (BA). La presencia del grupo amida y carboxilo en la estructura de los criogeles permitieron la remoción de plomo para aplicarlo en soluciones acuosas. La capacidad de remoción del plomo sobre el MPAAG-TBA ha sido determinando a diferentes pH, concentraciones del metal y tiempos de contacto. La técnica utilizada para la determinación de plomo en la solución acuosa fue el Espectrofotómetro de Absorción Atómica (AAS). La máxima capacidad de adsorción del MPAAG-TBA fue de 10,78 mg/L a pH5 en 30 minutos. El equilibrio de adsorción se realizó a concentraciones de 20,72; 41,44; 82,88 y 165,75 mg/L respectivamente de iones de Pb2+ sobre el MPAAG-TBA, resultados obtenidos fueron ajustados al modelo Langmuir and Freundlich. La capacidad máxima de adsorción se determinó mediante el modelo de Lagmuir, los valores de la intensidad de adsorción (RL) fueron menores que uno, indicando que la adsorción de plomo sobre el MPAAG-TBA es favorable, sin embargo no se ajusto al modelo en las primeras dos concentraciones. El coeficiente de regresión (R2) se utilizó el modelo de Freundlich y los valores de la intensidad (n) se encontraron en el intervalo de 1 a 10 considerándose favorable el proceso de remoción de Pb2+ sobre el MPAAG-TBA. Los resultados indican que los criogeles MPAAG-TBA podrían usarse como material adsorbente para remover los iones Pb2+ presentes en soluciones acuosas a bajas concentraciones.
Introducción
En la actualidad, existe una gran preocupación a nivel mundial, debido al considerable incremento en los índices de contaminación de efluentes industriales por parte de los metales pesados y a su vez son considerados potencialmente peligrosos en los organismos vivos por sus transformaciones químicas y su bioacumulación (Tejada-Tovar, Villabona-Ortiz, & Garcés-Jaraba, 2015). El plomo (Pb2+) ha sido reconocido como uno de los metales pesados más peligrosos, las principales fuentes de contaminación provienen de las actividades de minería y fundición, la combustión de gasolina con plomo, la aplicación a los suelos de lodos de depuradoras, la eliminación de baterías y los productos que contienen plomo (Huang et al., 2006). De acuerdo a la Organización Mundial de la Salud (OMS), estableció que la máxima concentración de iones de metales pesados en el agua debe estar en un rango de 0,01-1 ppm, sin embargo, en la actualidad se reportan concentraciones de iones de metales pesados hasta de 450 ppm en los efluentes (Tejada-Tovar et al., 2015).
Muchos procesos y tecnologías han sido desarrollados y aplicados para remover iones de metales pesados del agua, incluida la precipitación química, la extracción con disolventes de intercambio iónico, los depósitos de electrodos y la adsorción de carbón activado son bien conocidos pero caros. El uso de adsorbentes es uno de los métodos más efectivo tanto desde el punto de vista económico como tecnológico (Halah, Halah, & López-carrasquero, 2018); sin embargo muchos investigadores de otros países han demostrado su interés por este material y han sido introducidos como una nueva matriz para aplicaciones en diversos procesos de bioseparación (Carvalho et al., 2014), como la cromatografía de nano y micropartículas biológicas (Plieva et al., 2005), así como la separación, purificación, liberación de drogas, contaminantes ambientales biológicos, farmacéutica, médicas e ingeniería de tejidos (Sofia & Duarte, 2012; Zdravkovic, Nikolic, Ilic-Stojanovic, & Nikolic, 2017).
En Nicaragua el estudio de criogeles como material adsorbente, actualmente se está realizando en aplicaciones ambientales a escala de Laboratorio. Los criogeles basados en poli (acrilamida) (pAAm) han sido preparado mediante la técnica de criogelación (Ertürk & Mattiasson, 2014), las reacciones de polimerización a bajas temperaturas ocurre cuando la mayor parte del solvente (agua) se congela mientras que los reactivos disueltos se concentran en pequeñas regiones no congeladas, llamadas “microfase líquida”. La formación de gel en microfase líquida y los cristales de solventes congelados funcionan como porógeno (Plieva et al., 2005), estas características los hacen atractivos para la captura directa de biomacromoléculas (Carvalho et al., 2014). La retención de agua de criogel, la porosidad de la red y las propiedades de elasticidad les permiten aplicaciones como adsorbentes para diversos iones metálicos presentes en solución acuosa. Durante el proceso de adsorción, diversos autores mencionaron la formación de complejos de criogeles metálico a través de adición de los grupos funcionales (e.g., –COOH, –SO32–, –C = O (NH2), –SH, –COO–, –NH2 y –OH) (Halah, Halah, & López-carrasquero, 2018). La unión de grupos funcionales adecuados a la matriz del criogel es, además, una clave principal para una amplia gama de áreas de aplicación, por ejemplo, capturar productos farmacéuticos, unión a proteínas o inmovilización celular (Onnby, Giorgi, Plieva, & Mattiasson, 2010).
La búsqueda de alternativas para disminuir la contaminación del agua por plomo a través de las descargas de los efluentes provenientes de diversas actividades industriales y agrícola, se planteo este estudio cuyo objetivo fue remover los iones de plomo presentes en las en soluciones acuosas especialmente cuando se encuentra a bajas concentraciones mediante el uso de un material adsorbente llamado criogel que se encuentran unidos a grupos funcionales como aminas primarias y carboxílicos (MPAAG-TBA).
Materiales y Métodos
Materiales y reactivos
Acrilamida (AAm, > 99,9% puro, grado electroforesis), alil gliceril éter (AGE, 99%), N,N'-metilen-bis (acrilamina) (MBAAm) y persulfato de amonio (APS), ácido bromoacético, N,N,N’,N’-tetrametil-etilendiamina (TEMED), tris (2-aminoetil) amina (TREN), ácido 2,4,6-nitrobencenosulfamico (TNBS) fueron de Sigma-Aldrich, acetato de plomo trihidratado (CH3COO)2.3H2O)), ácido clorhídrico (HCl) y hidróxido de sodio (NaOH) grado reactivo, Ácido nítrico (HNO3), carbonato de sodio (Na 2CO3) y bicarbonato de sodio (NaHCO3), Solución estándar de 1000 mg/L-1 de Pb certificado.
Preparación de la solución de plomo
En el proceso experimental en modo batch se utilizó solución acuosa de iones de plomo y se prepararon a diferentes concentraciones (20,72; 41,44; 82,88 y 165,76 mg/L) a partir de la sal de Pb (CH3COO)2.3H2O. Para la determinación de la concentración de plomo en la solución acuosa se utilizó el equipo Espectrofotómetro de Absorción Atómica (AAS) mediante la preparación de un rango de trabajo utilizando una solución estándar certificado de 1000 mg/L a una longitud de onda de 283,3 nm.
Método para la polimerización del epoxi pAAm
Los pAAm-criogeles con grupos funcionales epoxi (epoxi pAAm) han sido producidos de acuerdo al estudio realizado por Onnby, et.al., 2010 y Plieva et.al., 2005. El contenido total de monómeros se adicionó en un erlemeyer 7,6 g de acrilamida; 3,2 g de MBAAm y 1,0 ml de AGE fueron disueltos en 170 ml agua des-ionizada para obtener una concentración final de 7,5 w/v%. Seguidamente se desgasificó durante 30 minutos, se adicionó 190 µl TEMED. El contenido fue colocado en un baño de hielo durante 30 minutos. Posteriormente se adicionó 152,6 mg de APS, la mezcla fue agitada rápidamente, luego fueron vertidos en las columnas de vidrio (15 ml, ID 9 mm) que contenía los carrier (moldes) y fueron colocados en un baño termostático a -12°C durante 1 h, luego fueron transferidos a un freezer a -12 °C durante una hora. Los tubos se dejaron a temperatura ambiente durante 30 minutos y fueron cortados de acuerdo al diámetro del carrier y colocados en agua desionizada. Se realizó lavados por agitación a 100 rpm durante 1 hora por tres veces consecutivas seguidamente fueron almacenados a 4 °C.
Adición de grupos ligandos (aminas y carboxilo)
Después de la preparación del epoxy-MPAAG, la adición de los grupos carboxílicos se realizó de la siguiente manera: la primera reacción consiste en adicionarle grupos ligandos que son las aminas primarias, se preparó el buffer de carbonato (NaHCO3: Na2CO3) 0,2 M a pH=9,2-9,4 a un volumen de 800 ml y se le adicionó 5,04 ml de tris(2aminoethyl) amine (TREN), seguidamente se adicionó el epoxy-MPAAG que fue obtenido de la criogelización, se dejó en agitación durante 15 h a 200 rpm, posteriormente el criogel fue lavado con agua desionizada para remover el exceso del reactivo.
Para verificar la unión del grupo TREN en el epoxy-MPAAG fue necesario tomar al azar el gel, se colocó en un vial que contenía 1 ml de carbonato de sodio pH = 8,5, se le agregó 2 μl de trinitro benceno-ácido sulfónico (TNBS). El cambio de color amarillo indicó que el ligando fue unido correctamente (ver figura 1).
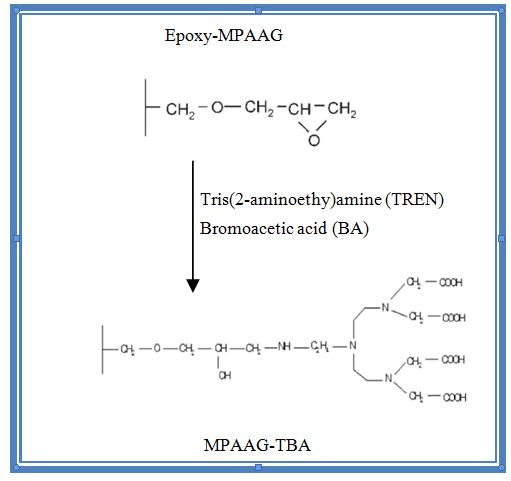
Figura 1. Epoxy-MPAAG reacciona con los ligantes TREN y BA para la obtención del material adsorbente MPAAG-TBA. Figura tomado de (Onnby et al., 2010).
La segunda reacción se realizó mediante la adición de un grupo carboxilo a partir de ácido bromoacético (BA) con una relación 4:1 (ácido bromoacético: MPAAG) a pH 8,7 que van unidas las aminas primarias de la primera reacción. La reacción se llevó a cabo durante 20 h a 300 rpm. El pH fue ajustado con NaOH concentrado, la solución debe de permanecer por encima de 8,5. El exceso de reactivo fue eliminando mediante enjuagues del MPAAG-TBA con agua desionizada.
Metodología analítica para determinar la influencia de pH y tiempo de contacto sobre el MPAAG-TBA
El método utilizado para este estudio fue como lo describe en su publicación Önnby, et. al., 2010, en modo batch utilizando 300 ml de solución acuosa de Pb (CH3COO)2.3H2O a una concentración de 207 mg/L para determinar la eficiencia de pH sobre el MPAAG-TBA con respecto al tiempo. El pH se evaluó experimentalmente en el rango de 2, 3, 4, 5 y 6, el ajuste se realizó con 0,1 M de NaOH o HCl 0,1 M, se utilizó 25 carrier conteniendo gel adsorbente equivalente a 0,56 g (peso seco). Se tomaron alícuotas de 10 ml entre 5 a 120 minutos a temperatura del laboratorio (24,5 ± 2 °C) con una agitación de 200 rpm. Las muestras fueron analizadas directamente en el equipo de Espectrofotómetro de Absorción Atómica (AAS).
Equilibrio de adsorción isoterma
Las isotermas y la cinética de los procesos de adsorción proporcionan información que determinan los mecanismos y la dinámica de adsorción. Estos mecanismos describen la cantidad de moléculas del adsorbato por unidad de masa del adsorbente en función de la concentración de equilibrio en la solución a una masa y temperatura constante (Bergmann, 2015; Dubey, Gusain, & Sharma, 2016).
Existen diferentes modelos de isoterma para determinar el equilibrio de adsorción experimental de un adsorbato en un adsorbente (Bergmann, 2015). En este estudio, los datos experimentales de equilibrio del Pb2+ adsorbido sobre MPAAG-TBA se analizaron mediante los modelos de isotermas de Langmuir y Freundlich.
El contenido de iones Pb2+ en la fase acuosa antes y después del proceso de adsorción se determinó utilizando el Espectrofotómetro de Absorción Atómica (AAS). La capacidad de adsorción, Qe (mg/g) se calculó de acuerdo a la siguiente ecuación:
(1)
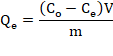
Donde C0 es la concentración inicial del metal en la solución (mg/L); Ce es la concentración del metal en el equilibrio (mg/L); V es volumen de la solución (L) y m es la masas del adsorbente (g) (Pourjavadi, Abedin-Moghanaki, & Hosseini, 2016).
Modelo isoterma de Langmuir
Es el modelo más utilizado y se basa en la cobertura de monocapa se produce en sitios homogéneos específicos en la superficie del adsorbente que tiene un número constante de sitios de adsorción idénticos y energéticamente equivalentes sin ninguna desviación hacia el plano de la superficie del adsorbente (Boparai, Joseph, & O’Carroll, 2011; Dubey et al., 2016). La forma no lineal de la isoterma de Langmuir es la siguiente:
(2)
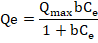
La ecuación 2 puede expresarse en forma lineal como se describe:
(3)
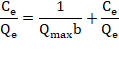
Donde Qmax representa la máxima capacidad de adsorción del metal (mg/g) y b es la constante de adsorción (L/mg) y se encuentra relacionada con la afinidad y la energía de los sitios de unión. Los valores numéricos de Qmax y b son obtenidos de la pendiente y el intercepto, respectivamente.
La características esenciales del modelo Langmuir puede expresarse por medio de una constante adimencional llamado factor de separación o parámetro de equilibrio (RL) (Ayawei, Ebelegi, & Wankasi, 2017; Bulut & Baysal, 2006; Foo & Hameed, 2010; Özcan, Gök, & Özcan, 2009; Sari, Tuzen, Citak, & Soylak, 2007). RL se calcula en la amplitud de las concentraciones iniciales del proceso de acuerdo a la siguiente ecuación:
(4)
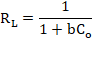
Donde b es la constante de adsorción de Langmuir (mg/g) y Co es la concentración inicial del adsorbente (mg/L). Los valores de RL indican la naturaleza de adsorción y es considerado el indicador más confiable para la isoterma de adsorción. Hay cuatro probabilidades del valor de RL, es no favorable cuando RL > 1, lineal cuando RL = 1, favorable cuando 0 < RL < 1 e irreversible cuando RL = 0.
Modelo isoterma de Freundlich
Se basa en la sorción multicapa en superficies heterogéneas que soportan sitios de afinidad variable y con una distribución uniforme de energía y adsorción reversibles (Dubey et al., 2016). La ecuación exponencial expresa que la concentración del adsorbato en la superficie del adsorbente aumenta a medida que aumenta la concentración del adsorbato. Teóricamente, usando esta expresión, ocurrirá una cantidad infinita de adsorción. Del mismo modo, la adsorción podría ocurrir a través de múltiples capas en lugar de una sola capa. La ecuación tiene una amplia aplicación en sistemas heterogéneos (Bergmann, 2015).
La forma no lineal de ecuación se escribe de la siguiente manera:
(5)
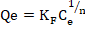
La forma lineal de la ecuación 5 se muestra como
(6)
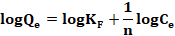
Donde KF y n son las constates de Freundlich relacionado a la capacidad de adsorción (mg/g) y la intensidad de adsorción respectivamente. La intensidad de adsorción (n) es la constante de equilibrio de adsorción, cuyo valor es indicativo de la heterogeneidad de la superficie del adsorbente (Pliego-Arreaga, Regalado, Amaro-Reyes, & García-Almendárez, 2013); es decir que los valores indican el grado de no linealidad entre la concentración y la adsorción de la siguiente manera: la adsorción es lineal si n = 1; la adsorción es un proceso químico si n < 1, la adsorción es un proceso físico si n > 1 y si n se encuentra en el rango de 1-10 indica que la adsorción es favorable (Borhade & Kale, 2017; Desta, 2013); KF (mg/g (L/mg)1/n) representa la cantidad de iones de metal adsorbido sobre el adsorbente para una unidad de concentración en equilibrio y Ce (mg/L) es la concentración en equilibrio (Dubey et al., 2016).
Resultados y discusiones
Polimerización e incorporación de los grupos ligandos
La preparación de MPAAG ha sido estudiada como lo describe Önnby, et.al., 2010. En la figura 2 se observa que el proceso de polimerización del MPAAG logrado a temperatura -12 ºC mediante el uso del termostato Isotemp. Como se ha mencionado en la metodología el proceso de incorporación de los grupos aminas y carboxilos fue realizado en dos etapas. Primeramente se realizó la adición del ligando grupos aminas (TREN) demostrándose mediante el cambio de coloración amarillo, así mismo indicó que se adicionó correctamente, estando disponible para la siguiente etapa que es la unión del grupo carboxílico (BC).

Figura 2: Polimerización de MPAAG a 7,5 %, -12 oC por 2 horas e incorporación de TREN y BA.
La determinación del peso seco del gel adsorbente (MPAAG-TBA) fue realizado a temperatura de 60 oC durante 24 h, por lo tanto cada carrier contiene 0,022 g de gel.
Influencia de pH y tiempo de contacto sobre el MPAAG-TBA en modo batch
El pH de la solución es uno de los factores importantes que afectan el comportamiento de adsorción, debido a su impacto en los grupos funcionales del adsorbente, así como a la solubilidad de los iones metálicos. Por lo tanto, la adsorción debe realizarse en el rango de pH óptimo (Pourjavadi et al., 2016). En la Figura 3 (a y b) se observa que el rango de pH fue de 2 a 6. Los resultados indicaron que la presencia de los grupos carboxílicos sobre el MPAAG-TBA demuestra su capacidad de adsorción del Pb2+ al aumentar el pH; sin embargo a pH 6 ocurrió un decrecimiento, debido a la formación de precipitado en la solución acuosa, según Qaiser, et. al 2009, el precipitado puede ser atribuido a la relación de los iones H+, como resultado del intercambio entre el Pb2+ y el protón, además causa sobresaturación de los poros del criogel a su vez deterioro del material adsorbente. La máxima capacidad (10,781 mg/g) de adsorción de Pb2+ fue a pH 5 donde alcanzó el equilibrio aproximadamente en 30 minutos. El pH 5 fue seleccionado como óptimo para el estudio de adsorción.
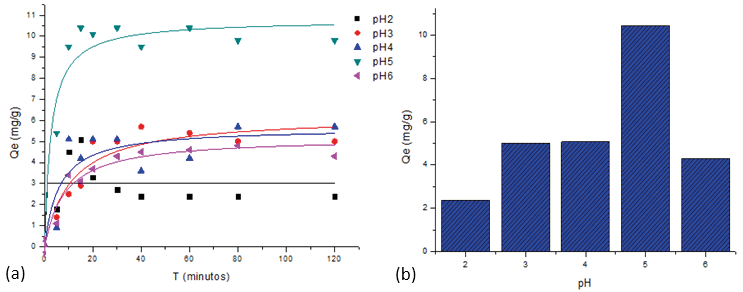
Figura 3. Efecto de pH y el tiempo de contacto con el MPAAG-TBA sobre la máxima capacidad de adsorción de Pb2+Langmuir, C= 207 mg/L, m=0,56 g en 300 ml a 24.5 ºC, 200 rpm, 120 minutos. Software origin pro8 V2019 análisis no lineal
El tiempo de contacto es uno de los factores importantes para la aplicación económica del tratamiento de aguas residuales (Abdul-Raheim, El-Saeed Shimaa, Farag, & Abdel-Raouf Manar, 2016; Pourjavadi et al., 2016). Para establecer el tiempo de contacto entre la solución acuosa que contiene 207 mg/L de iones Pb2+ sobre MPAAG-TBA el experimento fue llevado en un rango de 5 a 120 minutos. En la figura 3 (a) se observa que la máxima capacidad de adsorción tuvo lugar durante los primeros 30 minutos dentro del proceso de remoción de los iones de Pb2+, esto fue debido a la disponibilidad de los grupos ligantes como el carboxílicos, así como la resistividad del criogel como adsorbente.
En la tabla 1 se demuestran otros estudios comparativos de remoción de Pb2+ utilizando diferentes adsorbentes en función del pH y el tiempo de contacto con diferentes adsorbentes.
Tabla 1: Comparación del MPAAG-TBA con diferentes adsorbentes utilizados para la remoción de Pb2+.
|
Adsorbentes |
Qmax (mg/g) |
pH |
Tiempo (min) |
Referencias |
|
Fe3O4/cyclodextrin polymer nanocomposites |
64,5 |
5,5-6 |
45 |
(Badruddoza, Shawon, Tay, Hidajat, & Uddin, 2013) |
|
PAMAM-MNC |
310,0 |
5-6 |
30 |
(Pourjavadi et al., 2016) |
|
MPS-MNPs |
70,0 |
5,5 |
60 |
(Abdul-Raheim et al., 2016) |
|
AAM PEI/AAM |
18,2 19,0 |
6,0 6,0 |
48 h 48 h |
(Alam, Muyibi, & Toramae, 2007) |
|
MPAAG-TBA |
10,781 |
5,0 |
30 |
Presente estudio |
Equilibrio de adsorción isoterma
Los estudios cinéticos de adsorción son importantes en el tratamiento de efluentes acuosos porque proporcionan información valiosa sobre el mecanismo del proceso de adsorción. (Bergmann, 2015). El tratamiento estadístico que se utilizó para la interpretación de resultados y la evaluación del proceso para la determinación de los parámetros de equilibrio y cinética de adsorción fueron analizados por el método lineal y no lineal de acuerdo a la ecuación que se describe en el modelo isotermo Langmuir and Freundlich, haciendo uso del Programa Microsoft Excel y el origin Pro8 V2019.
Modelo isoterma Langmuir
El isoterma Lagmuir se considera un modelo de equilibrio capaz de identificar los mecanismos químicos involucrados en el estudio (Eren, 2009). En la figura 4 se observa el rango de concentración en estudio del Pb2+ sobre la capacidad de adsorción de MAAP-TBA de 0,56 g del peso seco a pH 5, los resultados obtenidos fueron a partir de las ecuaciones descritas del modelo isoterma Langmuir y Freundlich mediante el análisis no lineal.
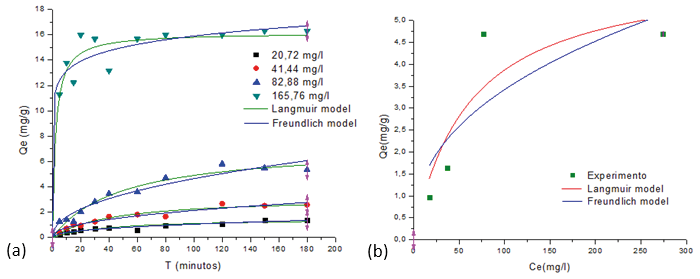
Figura 4 (a) (b). Equilibrio de adsorción utilizando el ajuste no lineal de la curva del modelo de isotermas Langmuir y Freundlich del Pb2+ sobre el MPAAG-TBA (C= 20,72; 41,44; 82,88 y 165,76 mg/L, m=0,56 g en 300 ml a 24.5 ºC, 200 rpm, 180 minutos. Software origin pro8 V2019 análisis no lineal
En la tabla 2 se demuestra que los valores correspondientes a los parámetros de adsorción isoterma Langmuir por el análisis no lineal en función de la concentración se obtiene que la capacidad máxima de adsorción (Qmax) fue de 1,537 a 16,163 mg/g, es decir Qmax es directamente proporcional al aumentar la concentración. El indicador de intensidad o parámetro de equilibro (RL) se encontró en un intevalo de 0,013 a 0,660, lo que indica que es un caso muy favorable (0 < RL<1) a su vez resultados demuestran que al aumentar Co el RL se acerca a cero.
Tabla 2: Parámetros de isotermas Langmuir y Freundlich para la remoción de Pb2+ sobre el MPAAG-TBA por el análisis no lineal.
|
Concentración (mg/L) |
||||
|
20,72 |
41,44 |
82,88 |
165,76 |
|
|
Langmuir |
||||
|
Qmax (mg/g) |
1,537 |
3,191 |
7,255 |
16,163 |
|
b (L/mg) |
0,025 |
0,023 |
0,021 |
0,443 |
|
RL |
0,660 |
0,507 |
0,367 |
0,013 |
|
Freundlich |
||||
|
KF (mg/g(L/mg)1/n) |
0,146 |
0,279 |
0,574 |
10,847 |
|
n |
2,338 |
2,268 |
2,203 |
12,036 |
|
1/n |
0,428 |
0,441 |
0,454 |
0,083 |
En la figura 5 se demuestra gráficamente la aplicabilidad del modelo isoterma Lagmuir mediante los datos obtenidos en el estudio de adsorción de iones Pb2+ a diferentes concentraciones sobre el criogel MPAAG-TBA, el coeficiente de regresión (R2) se encontró entre 0,668 a 0,992, lo que indica que no se ajustaron al modelo isoterma Lagmuir utilizando análisis lineal del software estadístico Origin Pro8 V2019.
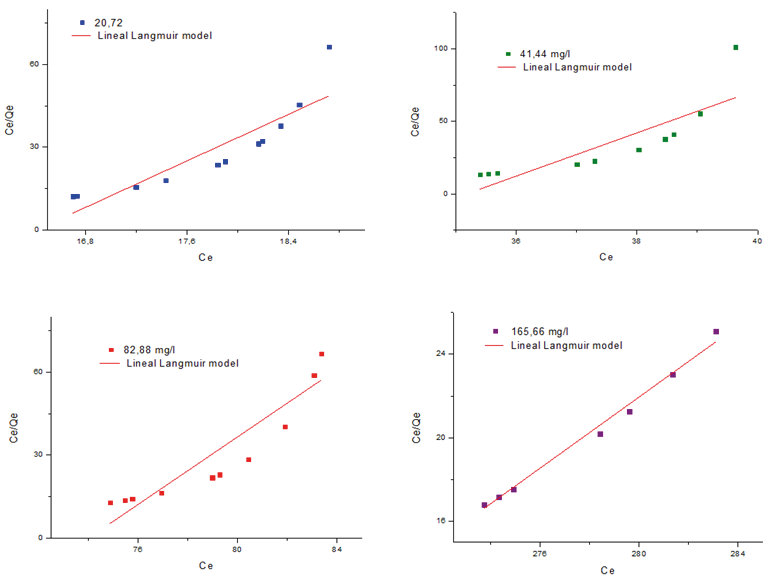
Figura 5. Modelo isoterma Langmuir para la remoción de Pb2+ sobre el MPAAG-TBA a diferentes concentraciones de ion Pb2+ (C= 20,72; 41,44; 82,88 y 165,76 mg/L, m=0,56 g en 300 ml a 24.5 ºC, 200 rpm, 180 minutos. Software origin pro8 V2019 análisis lineal.
En la tabla 2 se observa que el modelo isoterma Freundlich tiene el mismo comportamiento que la isoterma Langmuir debido que al aumentar las concentraciones del Pb2+ aumenta KF de 0,146 a 10,847 (mg/g(L/mg)1/n). Según (Alam et al., 2007) las constantes de Langmuir (Qmax) y Freundlich (KF) tienen diferentes significados, pero se llega a la misma conclusión sobre la correlación de los datos experimentales con el modelo de adsorción. La diferencia básica entre Qmax y KF es que la isoterma de Langmuir asume energía libre de adsorción independiente de la cobertura de la superficie y la formación de monocapa, mientras que la superficie sólida alcanza la saturación, la isoterma de Freundlich no predice la saturación de la superficie sólida por el adsorbato, y, por lo tanto, la cobertura de la superficie es matemáticamente ilimitada.
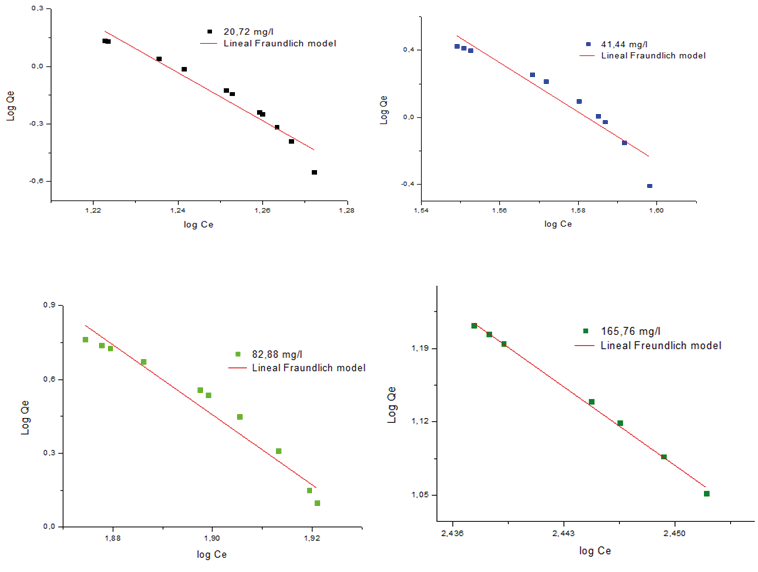
Figura 6. Modelo isoterma Freundlich para la remoción de Pb2+ sobre el MPAAG-TBA a diferentes concentraciones de ion Pb2+ (C= 20,72; 41,44; 82,88 y 165,76 mg/L, m=0,56 g en 300 ml a 24.5 ºC, 200 rpm, 180 minutos. Software origin pro8 V2019 análisis lineal.
La isoterma de Freundlich a través del análisis no lineal (Tabla 2) demuestra que los valores de n a las primeras tres concentraciones se encuentran en el intervalo de 2,203 a 2,338 indicando que la intensidad de adsorción es favorable (n=1-10), mientras que a concentración más alta se considera no favorable por encontrarse superior a 12,036.
En la figura 5 se demuestra gráficamente la aplicabilidad del modelo isoterma Freundlich. Los resultados obtenidos del coeficiente de regresión (R2) se encuentran en el intervalo de 0,907 a 0,937 demostrando que se ajusta al modelo de isoterma de adsorción al aplicarlo en análisis lineal utilizando el software estadístico Origin Pro8 V2019.
Conclusiones
La aplicabilidad del estudio utilizando criogel como adsorbente fue empleado para la remoción de plomo sobre el MPAAG-TBA. Las características de adsorción fueron llevadas a diferentes valores de pH y concentración a una temperatura constante en un proceso modo batch. El proceso de adsorción fue utilizando las isotermas de Langmuir y Fleundlich mediante los análisis no lineal y lineal aplicando el software Origin Pro8. El tiempo de equilibrio observado para el MPAAG-TBA fue de 30 minutos obteniendo su mayor capacidad de remoción a pH 5 a una velocidad de agitación de 200 rpm. Los datos experimentales no se ajustan al modelo de Langmuir en las primeras dos concentraciones, no obstante, el modelo de isoterma de Freundlich si se ajustan a los resultados. La remoción de plomo sobre el MPAAG-TBA resultó ser favorable, por lo tanto se puede concluir que MPAAG-TBA es un adsorbente eficiente para la remoción de plomo de las soluciones acuosas a bajas concentraciones.
Agradecimiento
Investigación financiada por los Fondos de Proyecto de Investigación 03201502 de la Universidad Nacional Autónoma de Nicaragua, Managua (UNAN-Managua).
Referencias
Abdul-Raheim, A. R. M., El-Saeed Shimaa, M., Farag, R. K., & Abdel-Raouf Manar, E. (2016). Low cost biosorbents based on modified starch iron oxide nanocomposites for selective removal of some heavy metals from aqueous solutions. Advanced Materials Letters, 7(5), 402–409. https://doi.org/10.5185/amlett.2016.6061
Alam, Z., Muyibi, S. A., & Toramae, J. (2007). Statistical optimization of adsorption processes for removal of 2,4-dichlorophenol by activated carbon derived from oil palm empty fruit bunches. Journal of Environmental Sciences, 19(6), 674–677. https://doi.org/10.1016/S1001-0742(07)60113-2
Ayawei, N., Ebelegi, A. N., & Wankasi, D. (2017). Modelling and Interpretation of Adsorption Isotherms. Journal of Chemistry, 2017. https://doi.org/10.1155/2017/3039817
Badruddoza, A. Z. M., Shawon, Z. B. Z., Tay, W. J. D., Hidajat, K., & Uddin, M. S. (2013). Fe 3O 4/cyclodextrin polymer nanocomposites for selective heavy metals removal from industrial wastewater. Carbohydrate Polymers, 91(1), 322–332. https://doi.org/10.1016/j.carbpol.2012.08.030
Bergmann, C. P. (2015). Carbon Nanomaterials as Adsorbents for Environmental and Biological Applications. https://doi.org/10.1007/978-3-319-18875-1
Boparai, H. K., Joseph, M., & O’Carroll, D. M. (2011). Kinetics and thermodynamics of cadmium ion removal by adsorption onto nano zerovalent iron particles. Journal of Hazardous Materials, 186(1), 458–465. https://doi.org/10.1016/j.jhazmat.2010.11.029
Borhade, A. V., & Kale, A. S. (2017). Calcined eggshell as a cost effective material for removal of dyes from aqueous solution. Applied Water Science, 7(8), 4255–4268. https://doi.org/10.1007/s13201-017-0558-9
Bulut, Y., & Baysal, Z. (2006). Removal of Pb(II) from wastewater using wheat bran. Journal of Environmental Management, 78(2), 107–113. https://doi.org/10.1016/j.jenvman.2005.03.010
Carvalho, B. M. A., Da Silva, S. L., Da Silva, L. H. M., Minim, V. P. R., Da Silva, M. C. H., Carvalho, L. M., & Minim, L. A. (2014). Cryogel poly(acrylamide): Synthesis, structure and applications. Separation and Purification Reviews, 43(3), 241–262. https://doi.org/10.1080/15422119.2013.795902
Deng, L., Su, Y., Su, H., Wang, X., & Zhu, X. (2007). Sorption and desorption of lead (II) from wastewater by green algae Cladophora fascicularis. Journal of Hazardous Materials, 143(1–2), 220–225. https://doi.org/10.1016/j.jhazmat.2006.09.009
Desta, M. B. (2013). Batch sorption experiments: Langmuir and freundlich isotherm studies for the adsorption of textile metal ions onto teff straw (eragrostis tef) agricultural waste. Journal of Thermodynamics, 1(1). https://doi.org/10.1155/2013/375830
Dubey, S., Gusain, D., & Sharma, Y. C. (2016). Kinetic and isotherm parameter determination for the removal of chromium from aqueous solutions by nanoalumina, a nanoadsorbent. Journal of Molecular Liquids, 219, 1–8. https://doi.org/10.1016/j.molliq.2016.01.021
Eren, E. (2009). Removal of lead ions by Unye (Turkey) bentonite in iron and magnesium oxide-coated forms. Journal of Hazardous Materials, 165(1–3), 63–70. https://doi.org/10.1016/j.jhazmat.2008.09.066
Ertürk, G., & Mattiasson, B. (2014). Cryogels-versatile tools in bioseparation. Journal of Chromatography A, 1357, 24–35. https://doi.org/10.1016/j.chroma.2014.05.055
Foo, K. Y., & Hameed, B. H. (2010). Insights into the modeling of adsorption isotherm systems. Chemical Engineering Journal, 156(1), 2–10. https://doi.org/10.1016/j.cej.2009.09.013
Halah, E., Halah, A. El, & López-carrasquero, F. (2018). Applications of hydrogels in the adsorption of metallic ions Aplicación de hidrogeles in la adsorción de iones metálicos. Ciencia e Ingeniería, 39(1), 57–70.
Huang, D. L., Zeng, G. M., Jiang, X. Y., Feng, C. L., Yu, H. Y., Huang, G. H., & Liu, H. L. (2006). Bioremediation of Pb-contaminated soil by incubating with Phanerochaete chrysosporium and straw. Journal of Hazardous Materials, 134(1–3), 268–276. https://doi.org/10.1016/j.jhazmat.2005.11.021
Onnby, L., Giorgi, C., Plieva, F. M., & Mattiasson, B. (2010). Removal of heavy metals from water effluents using supermacroporous metal chelating cryogels. Biotechnology Progress, 26(5), 1295–1302. https://doi.org/10.1002/btpr.422
Özcan, A. S., Gök, Ö., & Özcan, A. (2009). Adsorption of lead(II) ions onto 8-hydroxy quinoline-immobilized bentonite. Journal of Hazardous Materials, 161(1), 499–509. https://doi.org/10.1016/j.jhazmat.2008.04.002
Pliego-Arreaga, R., Regalado, C., Amaro-Reyes, A., & García-Almendárez, B. E. (2013). Revista Mexicana de Ingeniería Química. Revista Mexicana de Ingeniería Química, 12(3), 505–511. Retrieved from http://www.redalyc.org/articulo.oa?id=62029966013
Plieva, F. M., Karlsson, M., Aguilar, M. R., Gomez, D., Mikhalovsky, S., & Galaev’, I. Y. (2005). Pore structure in supermacroporous polyacrylamide based cryogels. Soft Matter, 1(4), 303–309. https://doi.org/10.1039/b510010k
Pourjavadi, A., Abedin-Moghanaki, A., & Hosseini, S. H. (2016). Synthesis of poly(amidoamine)-graft-poly(methyl acrylate) magnetic nanocomposite for removal of lead contaminant from aqueous media. International Journal of Environmental Science and Technology, 13(10), 2437–2448. https://doi.org/10.1007/s13762-016-1063-7
Sari, A., Tuzen, M., Citak, D., & Soylak, M. (2007). Equilibrium, kinetic and thermodynamic studies of adsorption of Pb(II) from aqueous solution onto Turkish kaolinite clay. Journal of Hazardous Materials, 149(2), 283–291. https://doi.org/10.1016/j.jhazmat.2007.03.078
Sofia, M., & Duarte, N. (2012). Integrated Master in Chemical Engineering Cryogel composites for cadmium removal: evaluating combinations and adsorption by molecularly imprinted polymers.
Tejada-Tovar, C., Villabona-Ortiz, Á., & Garcés-Jaraba, L. (2015). Adsorción de metales pesados en aguas residuales usando materiales de origen biológico. TecnoLógicas, 18(34), 109. https://doi.org/10.22430/22565337.209
Zdravkovic, A., Nikolic, L., Ilic-Stojanovic, S., & Nikolic, V. (2017). The application of hydrogels based on N-isopropylacrylamide and anionic comonomers. Advanced Technologies, 6(1), 33–44. https://doi.org/10.5937/savteh1701033z